Introducción
El laberinto membranoso es una estructura ubicada dentro de la cápsula ótica en la porción petrosa del hueso temporal, formado por un conjunto de vesículas y conductos que contienen en su interior endolinfa. Conforma un sistema cerrado de circulación de líquido, que está separado de la perilinfa que lo rodea, quedando a su vez conformados en su interior los órganos de la audición y del equilibrio del organismo1–3. El hidrops endolinfático (HE) es la distensión de estos compartimentos endolinfáticos en el oído interno4,5 y desde la década de 1930 se conoce como un marcador histopatológico en pacientes con enfermedad de Ménière (EM)6–8.
La etiología del HE permanece aún desconocida, pero se han propuesto varias teorías. Es conocido que la hidropesía refleja los cambios en la anatomía del laberinto membranoso como consecuencia de la sobreacumulación de endolinfa. Por lo tanto, las posibles causas de la hidropesía incluyen una sobreproducción o una disminución en la absorción de endolinfa. Algunos autores sugieren que las causas son multifactoriales, involucrando una serie de mecanismos patogénicos9–11.
El diagnóstico de EM se basa en los criterios propuestos por la American Academy of Otolaryngology-Head and Neck Surgery12 y la Bárány Society13. Estos criterios diagnósticos consideran manifestaciones clínicas debido a la falta de medidas claras y objetivas para confirmar la EM.
Numerosas publicaciones sostienen que la resonancia magnética (RM) es un método útil para el diagnóstico de EM en la mayoría de los pacientes mediante la visualización in vivo de HE14–23; sin embargo, este puede estar presente en otros procesos patológicos, cuyo estudio excede el objetivo del presente trabajo23–25.
Se han utilizado diferentes secuencias de RM y otros métodos otoneurológicos para determinar y clasificar el HE26–36. Según Gurkov37, como resultado de la experiencia clínica y de la visualización de imágenes en pacientes con síntomas de trastornos del oído interno, se desarrolló el concepto de enfermedad del oído hidrópico, un cambio de paradigma de una clasificación basada en síntomas a una basada en imágenes radiológicas. Es así que establece dos categorías de acuerdo con su etiología: HE primario, cuando no se encuentra una causa identificable; y HE secundario, cuando es causado por enfermedades subyacentes del oído interno que son identificables mediante las imágenes. Como detallaremos más adelante, las secuencias optimizadas de recuperación de la inversión atenuada de fluido tridimensional (3D-FLAIR) luego de cuatro horas de la administración intravenosa de gadolinio (Gd) son las más utilizadas hasta el momento para el diagnóstico y la valoración del grado de HE, ya que permiten la visualización discriminada entre la endolinfa y la perilinfa, y por tanto su caracterización38.
Conceptos anatómicos
El conducto auditivo interno contiene el nervio facial, el nervio vestibulococlear, el nervio intermedio y la arteria laberíntica. El nervio vestibulococlear sale del tronco del encéfalo como un solo nervio ubicado posterosuperior al nervio facial para luego dividirse en los nervios coclear superior y vestibular cerca del poro acústico. Un asa de la arteria cerebelosa anteroinferior también ingresa al conducto auditivo interno en el 20-40% de los individuos, lo cual generalmente no tiene importancia clínica39.
La cápsula ótica está compuesta por el hueso temporal denso, que forma la estructura del oído interno y se segmenta en los canales semicirculares, el vestíbulo y la cóclea. Esta cápsula ósea contiene el laberinto membranoso, que está formado por conductos y sacos que contienen endolinfa, los cuales están separados del hueso circundante por líquido perilinfático. Dentro del vestíbulo óseo hay dos sacos membranosos que contienen líquido endolinfático. Uno de ellos se denomina utrículo y suele ser la estructura más grande, aunque varía en tamaño. Se encuentra posterosuperior al nivel axial del conducto semicircular lateral. Junto con los conductos semicirculares, forma parte de la pars superioris. El otro, denominado sáculo, es más pequeño y se encuentra anteroinferior en la pared medial del vestíbulo.
Dentro de los canales semicirculares hay conductos con los mismos nombres. Los conductos semicirculares superior y lateral están inervados por el nervio vestibular superior, mientras que el canal semicircular posterior está inervado por el nervio vestibular inferior. Los conductos presentan una dilatación focal en un extremo, en una región denominada ampolla.
La cóclea está formada por la escala media o conducto coclear, que contiene endolinfa, bordeado por dos canales con líquido perilinfático, llamados escala timpánica y escala vestibular. La escala media se encuentra entre estas estructuras, bordeada por la membrana de Reissner ventralmente, la membrana basilar dorsalmente y el ligamento espiral y la cápsula ótica lateralmente40–43 (Fig. 1).
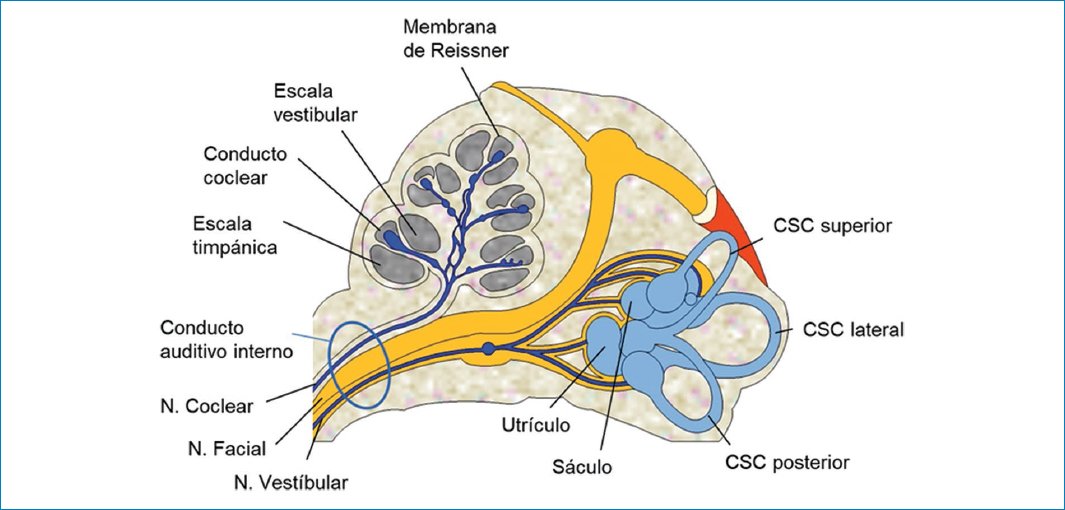
Figura 1. Representación esquemática del laberinto. CSC: canal semicircular; N: nervio.
Conceptos clínicos
La EM es una enfermedad idiopática del oído interno, multifactorial, que lleva el nombre del médico francés Prosper Ménière, descrita por primera vez en 1861.
Los síntomas clínicos de la EM son vestibulares, de vértigo recurrente, asociados a síntomas auditivos típicamente fluctuantes de hipoacusia neurosensorial de baja frecuencia, acúfenos o plenitud aural. Suele presentarse con síntomas unilaterales, pero es probable que la afectación bilateral se desarrolle en el 22-65% de los casos dentro de los 5-10 años posteriores44.
Técnica de estudio
De forma retrospectiva revisamos 362 estudios de RM con protocolo de hidrops, con un total de 724 laberintos. Se utilizó un equipo 3T (Discovery 750, GE, Wisconsin, USA) con bobina de cerebro de 32 canales de recepción para maximizar la relación señal/ruido. Primero se realizó un examen dedicado al oído sin contraste y tras la administración de Gd se obtuvo una secuencia volumétrica T1 del oído interno y de todo el cerebro. Luego de 4 h de la inyección (sin exceder 3,5-4,5 h) se adquirió la secuencia de hidrops. Para la obtención de imágenes de hidrops se utilizó la secuencia 3D-FLAIR, que es una técnica de inversión-recuperación que tras la inyección de contraste intravenoso (Gd) permite la anulación selectiva del espacio endolinfático. De esta manera se genera una imagen en la que se puede diferenciar la endolinfa, de señal hipointensa, de la perilinfa, de señal hiperintensa (realzada con Gd), mientras que el hueso circundante muestra una intensidad de señal similar a la endolinfa (Fig. 2). Las variaciones en el tiempo de inversión influyen en el tamaño aparente de las estructuras endolinfáticas, y por ello es recomendable que sea entre 2000 y 2500 ms45. Debido al pequeño calibre de las estructuras endolinfáticas, aplicamos un grosor de corte de 0,8 mm. Las secuencias de hidropesía se obtuvieron en el plano axial paralelo al canal semicircular lateral y se interpretaron junto con una secuencia 3D fuertemente ponderada en T2 del oído interno como referencia del espacio total de líquido del laberinto. Los tiempos de exploración para la secuencia 3D-FLAIR fueron de aproximadamente 8-9 min aplicando ángulos de inversión variables. Los parámetros de la secuencia 3D-FLAIR pueden variar y se resumen en la table 1.
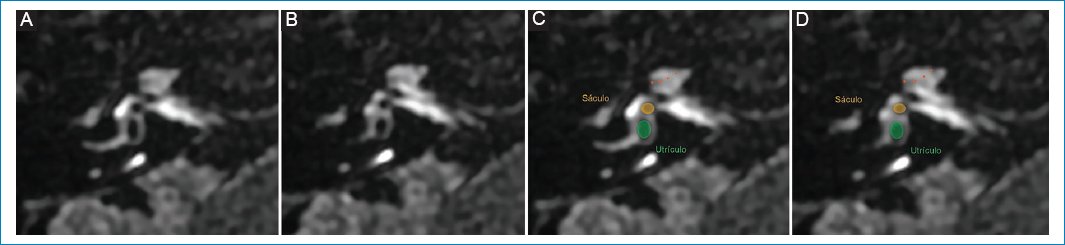
Figura 2. (A y B) Cóclea y vestíbulo normal; representación esquemática en C y D. A nivel coclear (puntos naranjas), la escala media o conducto coclear suele ser mínimamente visible; a nivel vestibular, el sáculo y el utrículo ocupan menos del 50% del área total del vestíbulo membranoso, siendo el sáculo (círculo amarillo) de menor tamaño que el utrículo (círculo verde).
Tabla 1. Protocolo de estudio de HE en un equipo de RM 3T
| Parámetros | 3D FLAIR |
|---|---|
| Canales | 32 |
| TE (ms) | 160 |
| TR (ms) | 9500 |
| TI (ms) | 2200 |
| FOV | 15 × 15 |
| Matriz | 212 × 212 |
| NEX | 4 |
| Tamaño vóxel (mm) | 0,7 × 0,7 × 0,8 |
| Ángulo volteo | Variable |
| Duración (min) | 7-8 |
|
FOV: campo de visión; NEX: número de excitaciones; TE: tiempo de eco; TI: tiempo de inversión; TR: tiempo de repetición. |
|
Clasificación del hidrops endolinfático
Para caracterizar el HE utilizamos la clasificación descrita por Bernaerts et al.46 en el año 2019, quienes propusieron cuatro grados de hidrops vestibular y tres grados de hidrops coclear según la gravedad de la afectación47.
A continuación, haremos una descripción detallada de los diferentes grados de HE siguiendo la clasificación de Bernaerts, mediante una serie de casos clínicos de nuestra institución.
Resonancia magnética en hidrops coclear
Paciente 1
Mujer de 17 años, con diagnóstico clínico de enfermedad de Ménière en oído derecho, medicada con betahistina y acetazolamida hace tres meses.
Se realizó RM de cerebro con protocolo para hidrops, observándose hallazgos sugestivos de hidrops coclear derecho de grado I (Fig. 3).
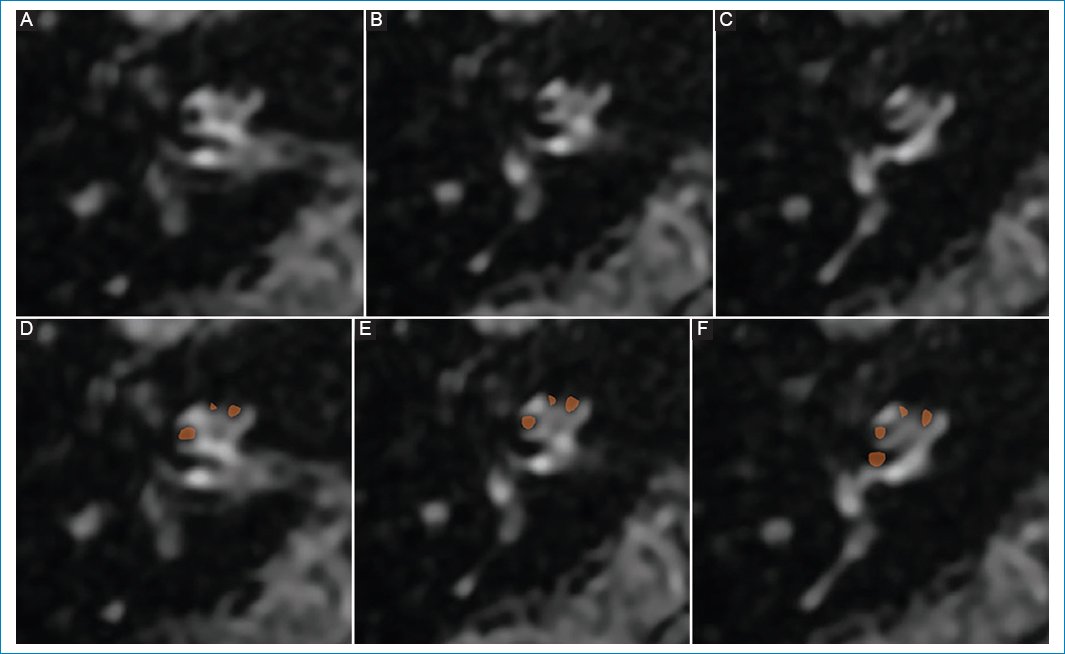
Figura 3. (A, B y C) Hidrops coclear de grado I: dilatación nodular de la escala media, vistas de superior a inferior; representación esquemática en D, E y F.
Paciente 2
Varón de 76 años que presenta hipoacusia del oído izquierdo y vértigo de un año de evolución. No estaba medicado. En la RM con protocolo de hidrops se evidenció una escala vestibular completamente obliterada debido a la distensión del conducto coclear, que se interpretó como hidrops coclear de grado II (Fig. 4).
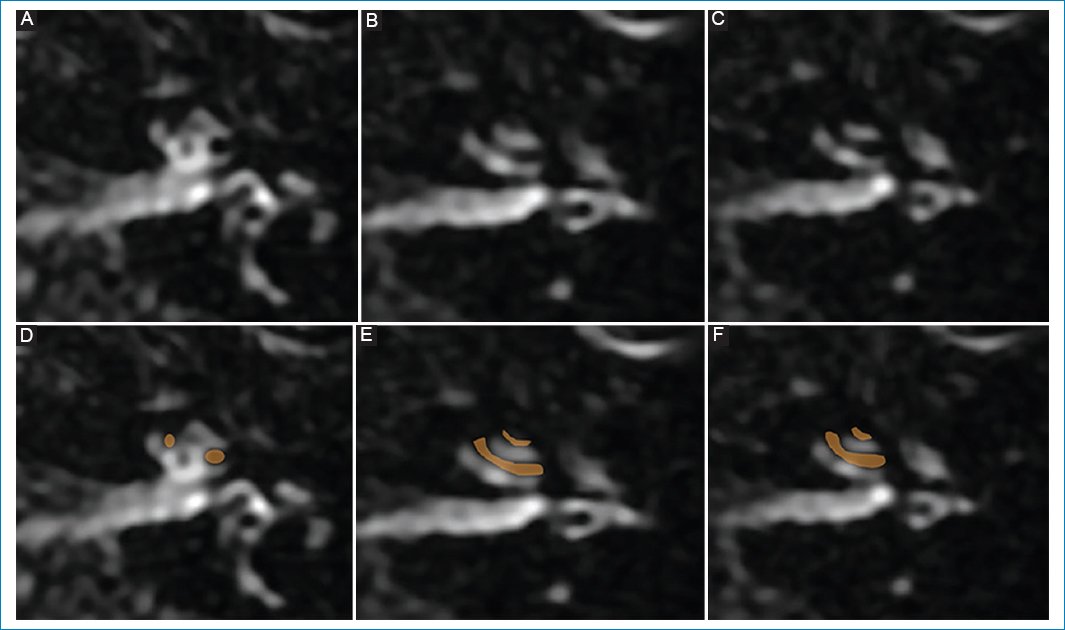
Figura 4. (A, B y C) Hidrops coclear de grado II: dilatación en banda de la escala media, vistas de superior a inferior; representación esquemática en D, E y F.
Resonancia magnética en hidrops vestibular
Paciente 3
Varón de 52 años con acufenos pulsátiles en el oído derecho y vértigo episódico. No tomaba medicación. La RM mostró hallazgos coincidentes con hidrops vestibular de grado I (Fig. 5).
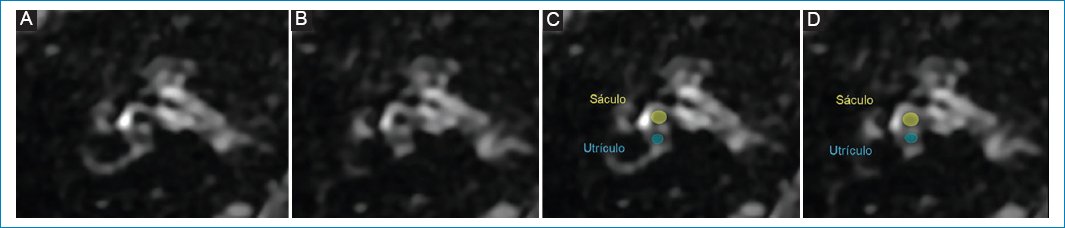
Figura 5. (A y B) Hidrops vestibular de grado I: dilatación del sáculo, vistas de superior a inferior; representación esquemática en C y D.
Paciente 4
Varón de 59 años que concurrió a la guardia por vértigo de más de un mes de evolución, hipoacusia del oído derecho, sensación de oído tapado y zumbidos aislados. Los síntomas habían aumentado de frecuencia en los últimos días. La RM evidenció hallazgos compatibles con hidrops vestibular de grado II (Fig. 6).
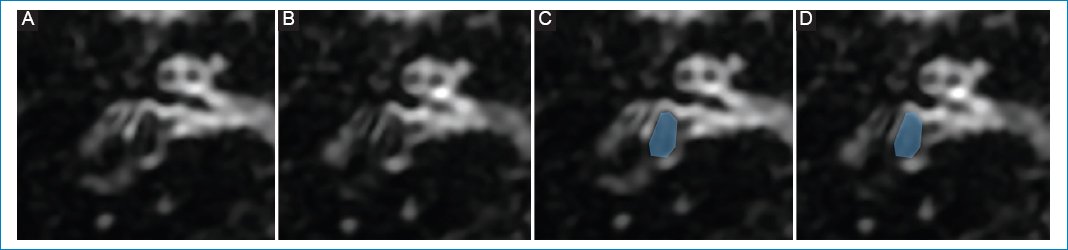
Figura 6. Hidrops vestibular de grado II: dilatación del sáculo y del utrículo con confluencia de ambos, persistiendo un fino realce perilinfático periférico, (A y B) vistas de superior a inferior; representación esquemática en C y D.
Paciente 5
Mujer de 49 años que presenta hipoacusia en el oído derecho y crisis de vértigo de cinco años de evolución, que se fueron incrementando en frecuencia. La RM con protocolo de hidrops mostró borramiento total de las estructuras vestibulares, tal como se describe en pacientes con hidrops vestibular de grado III (Fig. 7).
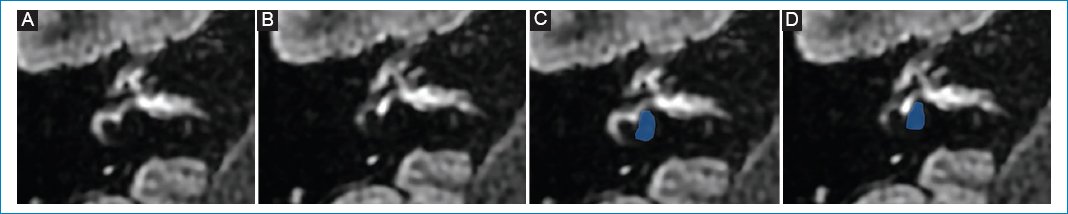
Figura 7. (A y B) Hidrops vestibular de grado III: dilatación del sáculo y del utrículo, con confluencia de ambos, y pérdida del reborde perilinfático, vistas de superior a inferior; representación esquemática en C y D.
Hallazgos asociados en la enfermedad de Ménière
Realce perilinfático
Además del HE, numerosos estudios de imágenes han informado un mayor realce perilinfático luego del contraste intravenoso, con respecto al oído contralateral sano, en los oídos afectados de pacientes con EM (Fig. 8), que representa un deterioro de la barrera hematolaberíntica. Sin embargo, la observación de deterioro de la barrera hematolaberíntica en la RM no es exclusiva de la EM, ya que se han informado hallazgos similares en la neuritis vestibular, la pérdida auditiva neurosensorial súbita y el schwannoma vestibular, entre otros22.
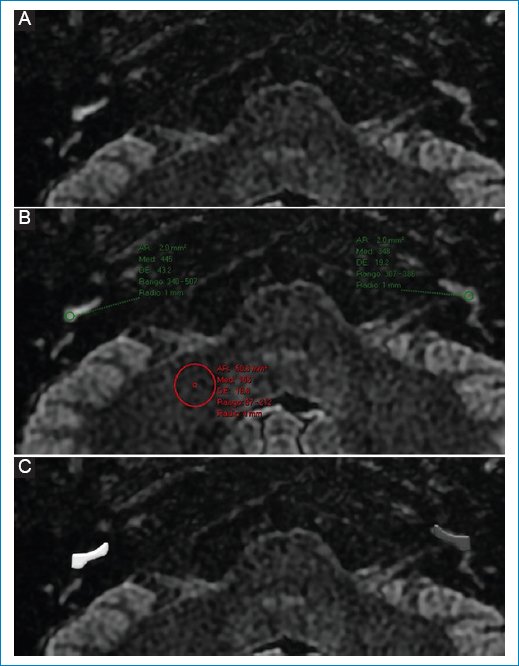
Figura 8. (A y B) Realce perilinfático aumentado en el giro basal de la cóclea derecha; representación esquemática en C.
Por lo tanto, el aumento de la intensidad de la señal de la perilinfa por sí solo no es específico. No obstante, la combinación de HE (mayormente vestibular) evaluado mediante la clasificación de Bernaerts y realce de la barrera hematolaberíntica muestra una sensibilidad del 85% y una especificidad del 92% para el diagnóstico de EM. Dichos hallazgos en conjunto tienen especial relevancia en pacientes cuya clínica atípica dificulta el diagnóstico definitivo, como es el caso de la probable EM22,46,47.
Sáculo no visible
Eliezer et al.48 reportaron la no visualización del sáculo en un subgrupo de pacientes con EM. Se ha planteado la hipótesis de que el mecanismo subyacente sea un colapso o una fístula del sáculo, lo que permite, al inyectar contraste intravenoso, una mezcla de endolinfa y perilinfa.
Conclusión
El HE es considerado el sello patognomónico de la EM. La RM en secuencia 3D-FLAIR con contraste diferido se ha convertido en la técnica de imagen de elección para demostrar y clasificar el HE.
Agradecimientos
Los autores agradecen a la Arq. Amelia Bernardo por el diseño de la figura 1.
Financiamiento
Los autores declaran no haber recibido financiamiento para este trabajo.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes. Además, los autores han reconocido y seguido las recomendaciones según las guías SAGER dependiendo del tipo y naturaleza del estudio.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Uso de inteligencia artificial para generar textos. Los autores declaran que no han utilizado ningún tipo de inteligencia artificial generativa en la redacción de este manuscrito ni para la creación de figuras, gráficos, tablas o sus correspondientes pies o leyendas.