Introducción
La resonancia magnética (RM) de alta resolución de la pelvis nos brinda la capacidad de reconocer la anatomía del recto y las estructuras vecinas, permitiendo identificar a aquellos componentes comprometidos por el tumor y de ese modo lograr una correcta estadificación local, diferenciando entre patología localmente limitada y localmente avanzada.
Nuestro trabajo tiene por objetivos mostrar mediante ejemplos iconográficos la anatomía topográfica del recto y demostrar la utilidad de la RM de alta resolución en la estadificación del cáncer rectal y en la identificación de los factores de mal pronóstico.
Protocolo de resonancia magnética de recto
Nuestro protocolo de estudio incluye secuencias de alta resolución potenciadas en T2 con un field of view (FOV) pequeño (200 mm), cortes de 3 mm de espesor, factor de distancia de 0, un TE de 109 y un TR en un rango de 4.500-7.000, dependiendo de la cantidad de cortes realizados. Estas imágenes son obtenidas en los planos sagital estricto, axial oblicuo y coronal oblicuo.
Primero, se realizó el plano sagital estricto para poder identificar la lesión; una vez visualizada esta, se planificó el plano axial oblicuo, perpendicular al eje tumoral, permitiéndonos visualizar su correcta relación con las estructuras anatómicas vecinas.
Con respecto al plano coronal oblicuo, en los casos en donde hubo compromiso únicamente del recto medio y/o superior se realizó siguiendo el eje longitudinal tumoral, mientras que cuando existía compromiso del recto inferior se planificó siguiendo el eje longitudinal del canal anal, permitiéndonos definir en forma adecuada el compromiso del complejo esfinteriano. En aquellos casos en que el tumor comprometía al recto inferior y medio, optamos por adquirir dos planos coronales, uno siguiendo al canal anal y otro al eje longitudinal tumoral en recto medio.
Además, se obtuvieron imágenes en el plano axial estricto potenciadas en T1 y T2 con un FOV mayor, de toda la pelvis, lo cual permitió la visualización de cadenas linfáticas distantes. También incluimos en nuestro protocolo la secuencia de difusión (DWI) con tres valores de b (b = 800, b = 1.000, b = 1.500).
Por último, aunque algunos autores consideran opcional el uso de espasmolíticos1,2, en nuestra experiencia la administración de butilbromuro de hioscina endovenoso antes de comenzar la exploración ha dado buenos resultados, inhibiendo el peristaltismo intestinal y por ende artefactos cinéticos en las imágenes obtenidas. Por otro lado, si bien está descripto en algunos artículos como uso opcional, no utilizamos en nuestros estudios gel endorrectal.
Anatomía del recto
Histológicamente, el recto está compuesto por tres capas concéntricas, siendo de interno a externo: la mucosa, la submucosa y la muscular propia. Por fuera de esta última se encuentra un componente adiposo: el mesorrecto, el cual está limitado externamente por la fascia mesorrectal (FMR), que se evidencia como una delgada línea hipointensa en secuencias potenciadas en T23 (Fig. 1).
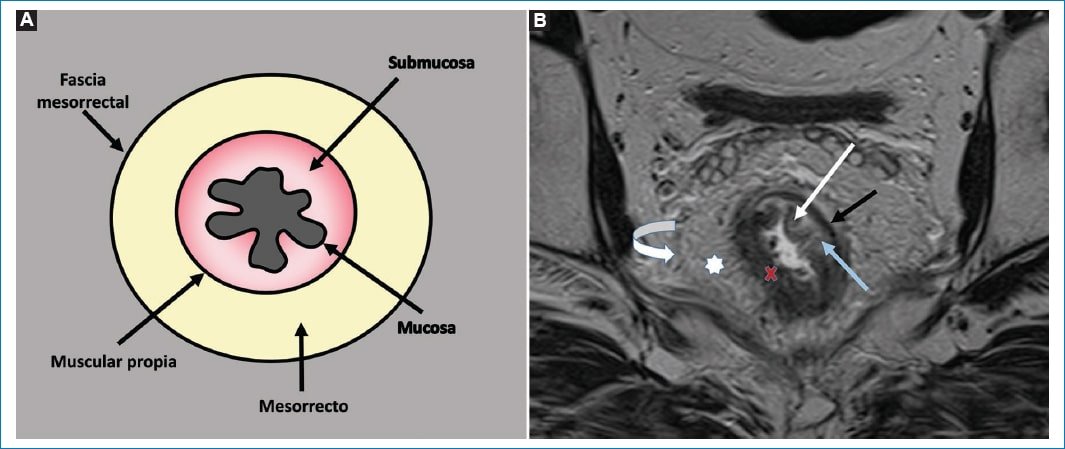
Figura 1. Anatomía del recto. A: Representación gráfica de un corte axial de recto donde se pueden visualizar las diferentes estructuras anatómicas que lo componen. B: Corte axial oblicuo de recto medio potenciado en secuencia T2, donde se pueden visualizar las diferentes estructuras anatómicas de la región: FMR (flecha curva), mesorrecto (estrella blanca) y las diferentes capas de la pared rectal: muscular propia (flecha negra), submucosa (flecha celeste) y mucosa (flecha blanca). Además, se puede identificar una lesión tumoral (cruz roja) que compromete las tres capas de la pared rectal, alcanzando al mesorrecto.
Se debe determinar con certeza si la lesión se encuentra a nivel rectal o en el colon sigmoides, ya que en ambos casos existe un abordaje quirúrgico distinto3. Uno de los métodos más utilizados por las guías internacionales para la definición de tumor de recto es la medición de la distancia entre la porción distal de este y el margen anal, considerando a todos aquellos tumores ubicados a una distancia ≤ 15 cm del margen anal como tumor rectal. A su vez, se los subclasifica en tumores de recto superior, medio y/o inferior (Fig. 2)3–5. El recto es un órgano con una porción intraperitoneal y otra extraperitoneal, que pueden ser diferenciadas mediante la identificación de una fina membrana hipointensa en T2 correspondiente a la reflexión peritoneal anterior. Esta suele visualizarse en el plano sagital y une las vesículas seminales en el hombre y el fondo de saco de Douglas en la mujer, con la cara anterior del recto medio (Fig. 3)3,6. Por encima de esta, el peritoneo recubre las caras anterior y lateral del recto superior y la cara anterior del recto medio, mientras que el recto inferior es completamente extraperitoneal6. A su vez, la FMR rodea completamente al mesorrecto por debajo de la reflexión peritoneal y por su caras laterales y posteriores por encima de esta3 (Fig. 4).
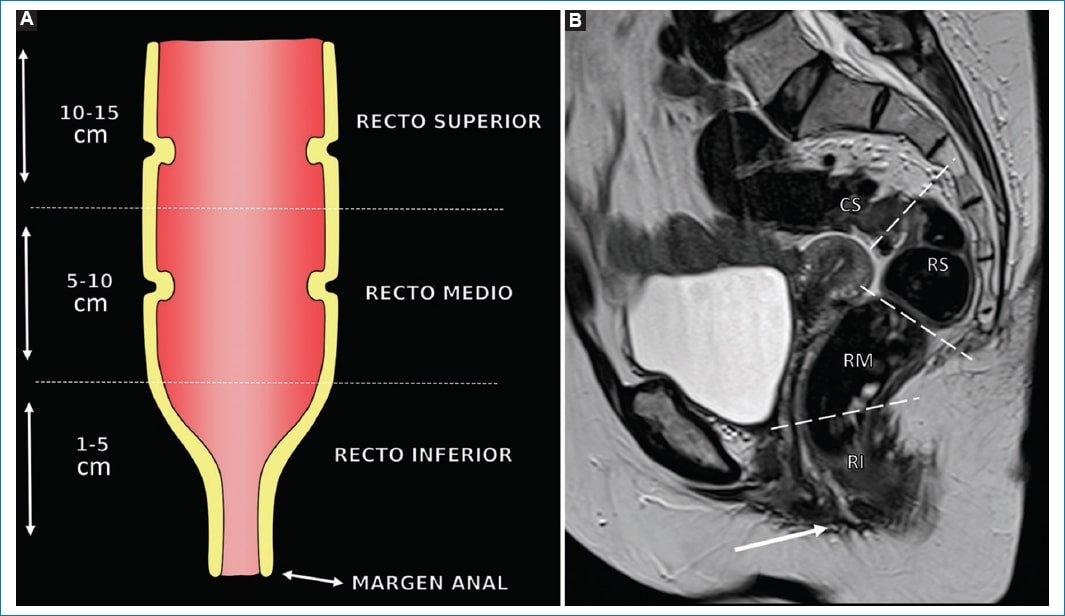
Figura 2. Anatomía topográfica del recto. A: Representación gráfica de la anatomía topográfica del recto teniendo en cuenta como referencia la distancia al margen anal. B: Imagen en el plano sagital potenciada en T2 del recto. Las líneas de trazo marcan las divisiones entre recto inferior (RI), recto medio (RM), recto superior (RS) y colon sigmoides (CS) teniendo en cuenta la distancia al margen anal (flecha blanca).
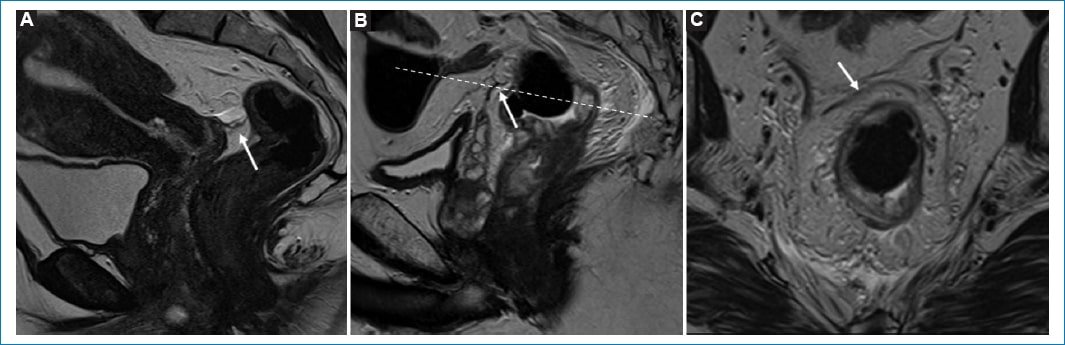
Figura 3. Reflexión peritoneal anterior. Imágenes en el plano sagital potenciadas en secuencia T2 (A y B) donde se observa una delgada línea hipointensa correspondiente a la reflexión peritoneal anterior (flecha blanca). En la mujer (A) la reflexión peritoneal anterior se extiende desde el recto medio hasta el fondo de saco de Douglas, para luego continuarse por la cara posterior del útero como peritoneo visceral. En el hombre (B) se extiende desde la cara anterior del recto medio hasta las vesículas seminales. C: Imagen en el plano axial oblicuo potenciada en T2, correspondiente a la altura donde se encuentra la línea de trazo en la imagen B, donde se observa una delgada línea hipointensa por delante del recto medio correspondiente a la reflexión peritoneal anterior (flecha blanca).
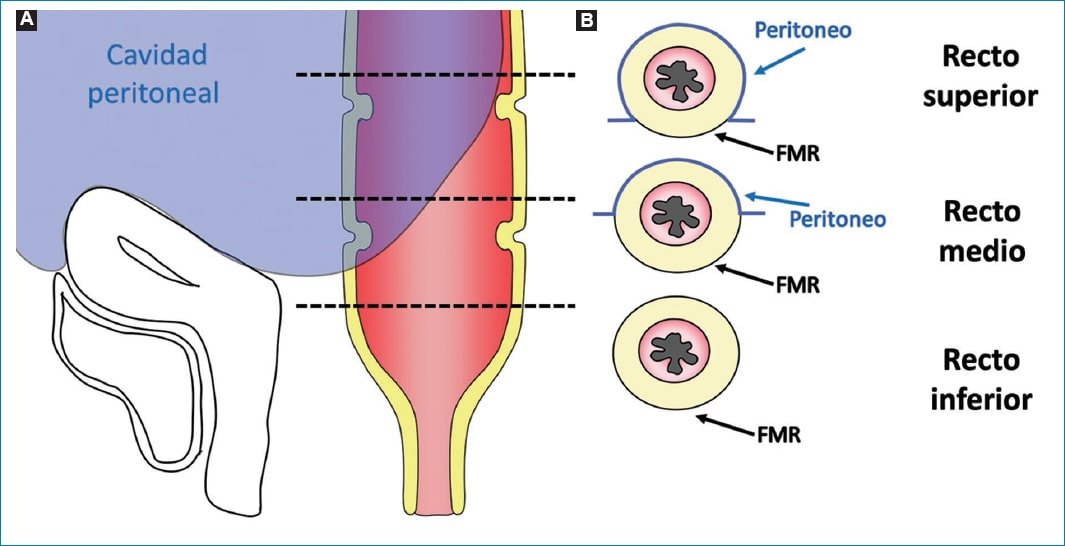
Figura 4. Relaciones anatómicas entre el recto y el peritoneo. Figura esquemática de las relaciones anatómicas entre el recto y el peritoneo, donde se observa que una porción del recto superior y medio es intraperitoneal (zona azul), mientras que el resto es extraperitoneal. Las líneas de trazo marcan los diferentes niveles de corte de las imágenes axiales esquematizadas, en las cuales se identifica que el peritoneo cubre casi la totalidad del mesorrecto a nivel del recto superior exceptuando su porción posterior, cubierta por la FMR. A nivel del recto medio la porción peritonizada se limita a la cara anterior y parte de los laterales, mientras que el mesorrecto a nivel del recto inferior está recubierto por todas sus caras por la FMR.
En sentido caudal, debemos identificar la unión ano-rectal y el margen anal, para de esa forma identificar el canal anal. Esta unión ano-rectal se encuentra en íntima relación con el anillo puborrectal y la porción proximal del esfínter anal externo, para identificar esta se toma como punto de referencia una línea imaginaria que une la cara inferior del pubis y el sacro3 (Fig. 5).
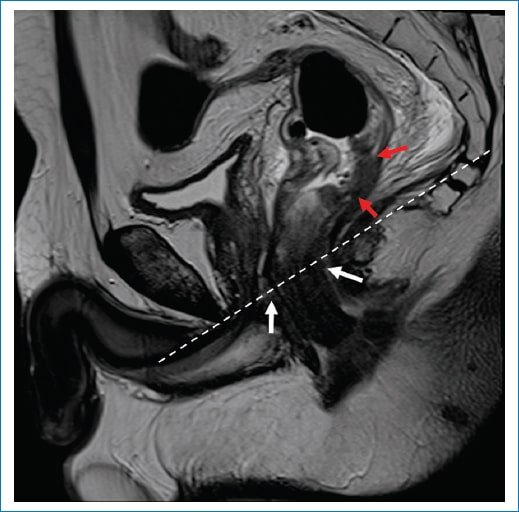
Figura 5. Anillo puborrectal. Imagen obtenida en el plano sagital y potenciada en secuencia T2 de recto. La línea de trazo se extiende desde la cara inferior del pubis hacia la cara inferior del sacro, sirviendo de referencia para la ubicación del anillo puborrectal (flechas blancas). Además, se identifica una lesión tumoral que compromete la pared posterior del recto medio (flechas rojas).
Otra estructura que el radiólogo debe reconocer es el esfínter anal. Este está compuesto por una capa interna, el esfínter anal interno, que es continuación de la capa muscular interna del recto; rodeado por una capa externa de músculo estriado, el esfínter anal externo, el cual se encuentra en relación con los músculos elevadores del ano y del anillo puborrectal. Ambas capas se encuentran separadas por un espacio de tejido adiposo de grosor variable: el espacio interesfinteriano7 (Fig. 6).
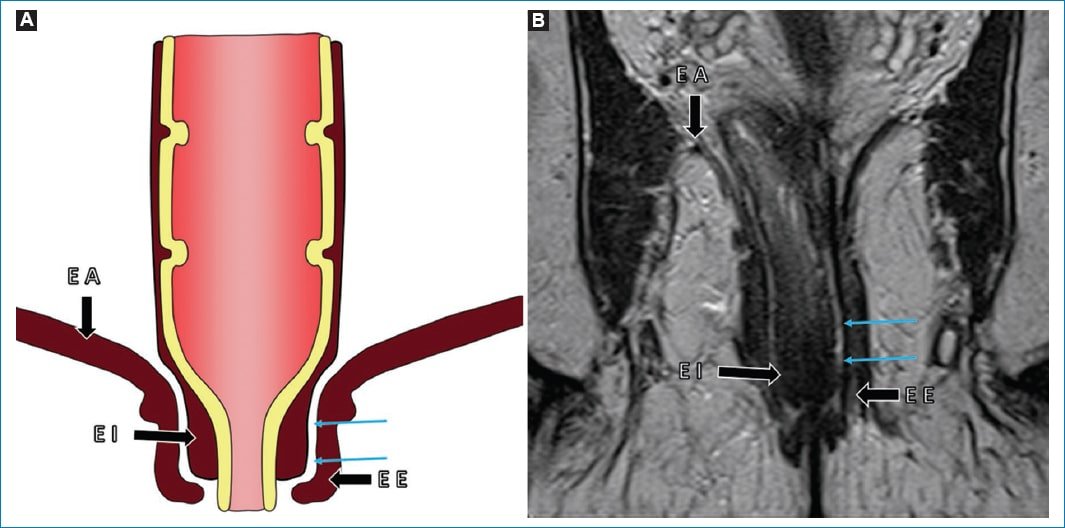
Figura 6. Complejo del esfínter anal. A: Representación esquemática de las estructuras que componen al esfínter anal. B: Imagen obtenida en el plano coronal y potenciada en secuencia T2, angulada sobre el canal anal, donde se puede observar: el músculo elevador del ano (EA), el esfínter interno (EI), el esfínter externo (EE) y el espacio interesfinteriano (flechas celestes).
Por otro lado, no solo debemos describir la ubicación topográfica de las lesiones, sino también describir su patrón de crecimiento (endofítico y/o exofítico), si generan compromiso completo o no de la circunferencia rectal o si generan estenosis de su luz. En este aspecto, nos es útil ubicar las lesiones en el plano circunferencial siguiendo el eje de las agujas del reloj (Fig. 7).
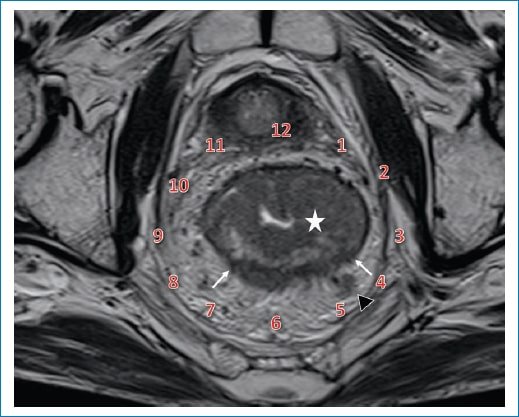
Figura 7. Ubicación de las lesiones por el método del reloj. Imagen axial oblicua obtenida perpendicular al eje longitudinal tumoral, potenciada en T2, a nivel del recto medio. Se identifica una lesión tumoral con compromiso circunferencial del recto (estrella blanca). Siguiendo el método de ubicación según el reloj, se puede describir que el tumor se extiende más allá de la muscular propia entre la hora 4 (H4) y la hora 7 (H7) (flechas blancas). A nivel del mesorrecto se visualiza también una imagen ganglionar (punta de flecha). En este caso, el tumor fue estadificado como T3c, debido a que presenta una extensión de aproximadamente 6 mm hacia el mesorrecto.
Estadio T
Teniendo en cuenta la clasificación TNM del cáncer rectal (Tabla 1), el estadio T queda definido por el grado de compromiso mural, la extensión extramural del tumor y el compromiso de estructuras adyacentes (Fig. 8).
Tabla 1. Clasificación TNM del cáncer de recto
| Categoría T | |
|---|---|
| T1 | Compromiso limitado a la submucosa |
| T2 | Compromiso tumoral que alcanza la muscular propia |
| T3 | Compromiso que se extiende más allá de la muscular propia: |
| T3a | Extensión menor a 1 mm |
| T3b | Extensión 1-5 mm |
| T3c | Extensión 5-15 mm |
| T3d | Extensión mayor a 15 mm |
| T4 | Compromiso de peritoneo/órganos vecinos |
| T4a | Tumor que compromete la reflexión peritoneal anterior |
| T4b | Tumor que invade o se adhiere a otros órganos o estructuras |
| Categoría N | |
| N1a | 1 nódulo linfático |
| N1b | 2-3 nódulos linfáticos |
| N1c | Depósito tumoral en la subserosa, mesenterio o tejidos no peritonizados |
| N2a | 4-6 nódulos linfáticos |
| N2b | 7 o más nódulos linfáticos |
| Categoría M | |
| M1 | Metástasis a distancia |
| M1a | Metástasis en un único órgano o estructura |
| M1b | Metástasis en más de un órgano y/o estructura o diseminación peritoneal |
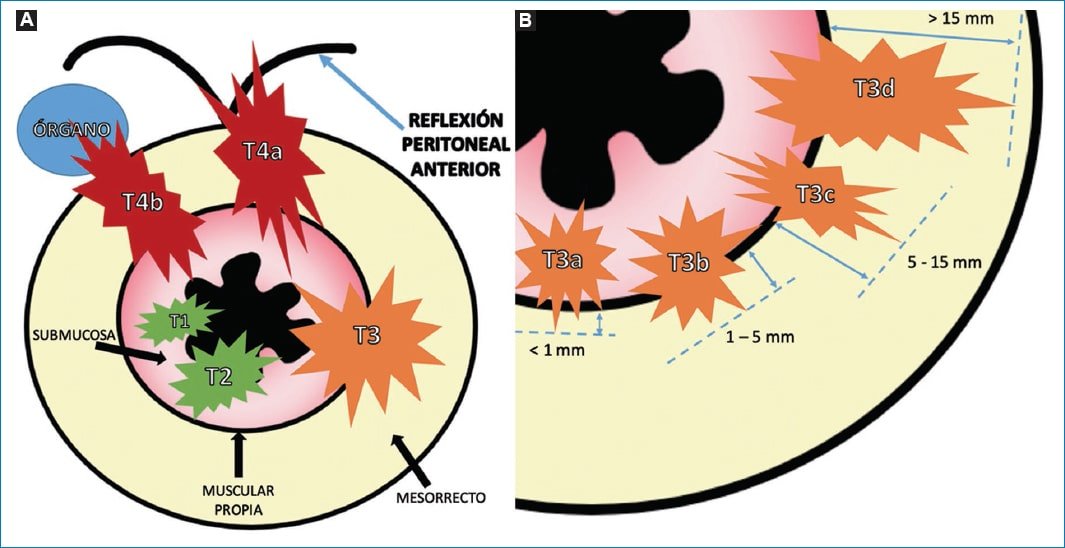
Figura 8. Representación gráfica de la estadificación T. A: Representación esquemática de los diferentes estadios de T. Se puede observar cómo los estadios T1 y T2 se limitan a la pared intestinal, no extendiéndose más allá de la muscular propia. El estadio T3 se extiende más allá de la pared intestinal y alcanza el mesorrecto mientras que el estadio T4a compromete la reflexión peritoneal anterior y el T4b a órganos vecinos. B: Se observa la diferente subclasificación del estadio T3. Las flechas celestes indican de qué forma debe medirse la extensión de la invasión, midiendo desde la muscular propia hasta la mayor distancia alcanzada por el tumor (línea de trazo). Los valores expresados en milímetros (mm) son el nivel de extensión tumoral correspondiente a cada subestadio.
Los estadios T1 y T2 (Fig. 9) incluyen aquellos tumores limitados a la pared intestinal, siendo diferenciados según se limiten a la submucosa o alcancen la muscular propia. Aquellos tumores con estadio T1 generan una caída en la intensidad de la señal de la submucosa respecto a aquella respetada, mientras que los estadios T2 contactan con la muscular propia, la cual se puede visualizar engrosada2,8–10. Cuando la invasión tumoral alcanza el mesorrecto, sin comprometer a órganos adyacentes, estamos ante un estadio T3. Estos tumores presentan cuatro subcategorías según la distancia entre la muscular propia y el margen distal de invasión tumoral, el cual se mide desde el punto comprometido de la muscular propia hasta el punto de mayor extensión tumoral: T3a, < 1 mm; T3b, 1-5 mm; T3c, 5,1-15 mm y T3d, ≥ 15 mm2,8–10 (Fig. 10).
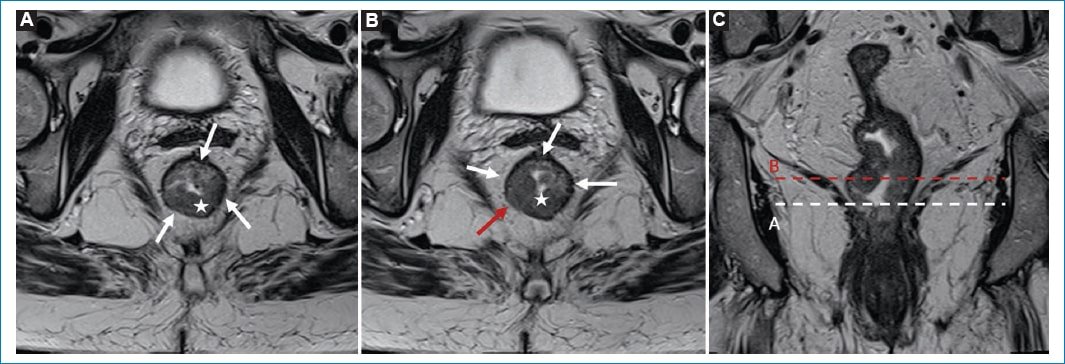
Figura 9. Compromiso limitado a la pared intestinal. A: Imagen axial oblicua de recto medio potenciada en T2, donde se puede observar una lesión tumoral (estrella blanca) que no compromete la muscular propia (flechas blancas) en este nivel, simulando un estadio T1. B: Imagen obtenida del mismo paciente en un nivel superior en donde se constata que el tumor infiltra la muscular propia (flecha roja) conformando un estadio T2. C: Imagen coronal potenciada en T2 siguiendo el eje longitudinal del tumor, donde se muestran los niveles de las imágenes A y B.
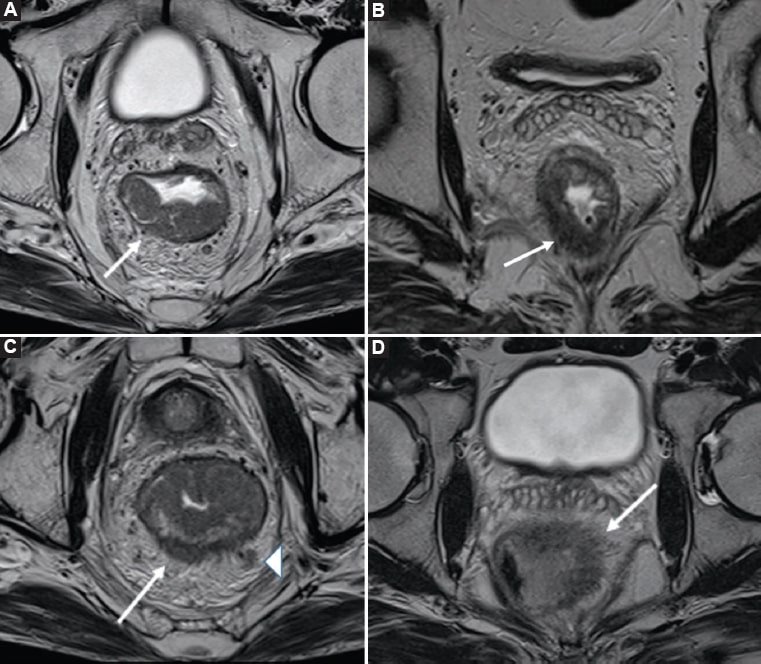
Figura 10. Tumor T3. Imágenes potenciadas en T2, obtenidas en planos axiales oblicuos, perpendicular al eje tumoral, de varios pacientes, donde se pueden visualizar los diferentes subestadios de T3. A: Lesión tumoral que se extiende más allá de la muscular propia una extensión menor a 1 mm (flecha blanca), compatible con estadio T3a. B: Lesión tumoral que se extiende aproximadamente 3 mm en el mesorrecto (flecha blanca), definida como estadio T3b. C: Lesión tumoral con un compromiso de 6 mm desde la muscular propia (flecha blanca), compatible con estadio T3c; también se identifica un ganglio linfático mesorrectal (punta de flecha). D: Extensión tumoral de aproximadamente 16 mm (flecha blanca), sugestiva de estadio T3d.
Por último, la clasificación TNM subdivide al estadio T4 en aquel que compromete solo a esta reflexión peritoneal (T4a) (Fig. 11) y aquel que invade órganos vecinos (T4b)2,3,10 (Fig. 12).
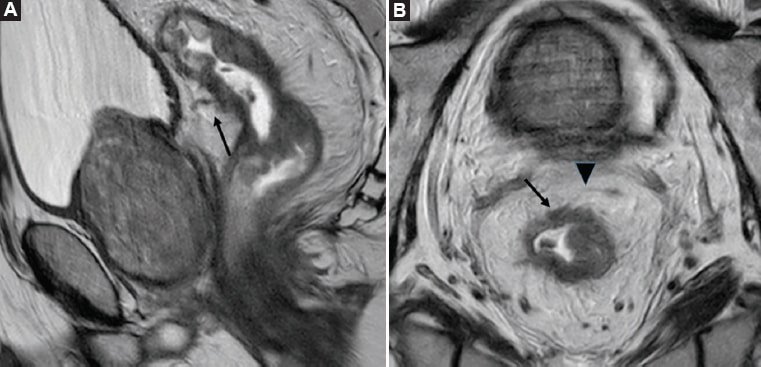
Figura 11. Estadio tumoral T4a. A: Imagen en el plano sagital potenciada en T2 de paciente con tumor de recto medio y superior, observándose compromiso de la pared rectal adyacente a la reflexión peritoneal, generando una mínima retracción de esta (flecha negra). B: Imagen axial oblicua, perpendicular al eje longitudinal tumoral y potenciada en T2 del mismo paciente, donde se visualiza un engrosamiento de la pared rectal que compromete a la reflexión peritoneal anterior (flecha negra). La punta de flecha indica una porción distal de la reflexión peritoneal anterior.
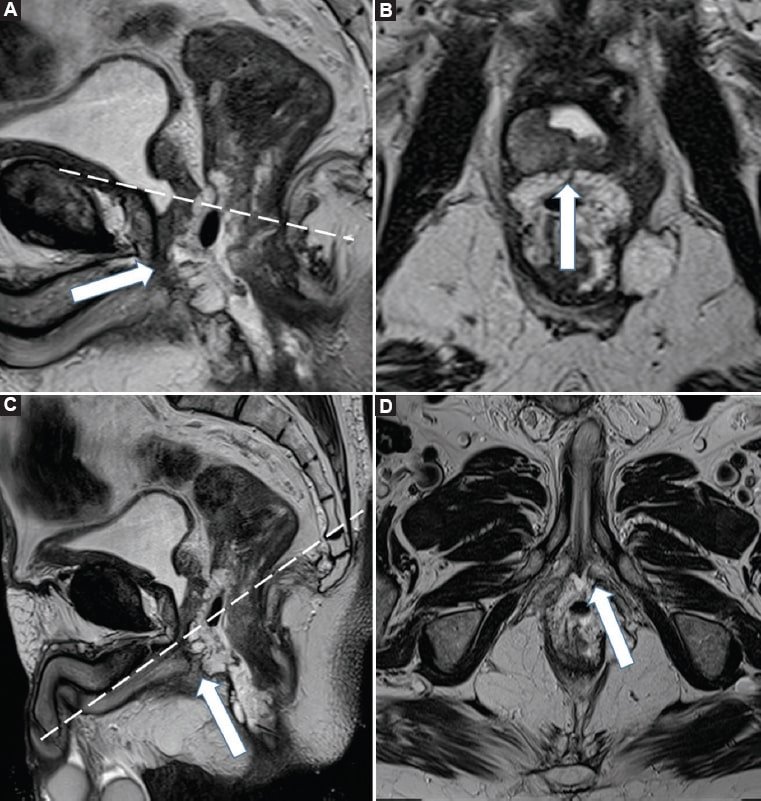
Figura 12. Estadio tumoral T4b. A y B: Imágenes potenciadas en T2 obtenidas en los planos sagital y axial oblicuo (angulada en forma perpendicular al eje longitudinal de la lesión), donde se constata un tumor de recto que se extiende desde el canal anal hasta recto superior. Se identifica como la lesión tumoral se encuentra en íntimo contacto con la próstata y la base del pene (flecha blanca). C y D: Imágenes potenciadas en T2 obtenidas en los planos sagital y axial oblicuo (angulada en forma perpendicular al canal anal) del mismo paciente donde se identifica el compromiso de la base del pene (flecha blanca). Nótese cómo la realización de dos angulaciones axiales oblicuas, una siguiendo el eje longitudinal del tumor en el recto medio y otra siguiendo el eje longitudinal del canal anal, permitió la correcta determinación del compromiso de las estructuras vecinas.
Margen circunferencial de resección
Si bien existen procedimientos mínimamente invasivos para el tratamiento de los estadios T1 y algunos T2, la cirugía de escisión total del mesorrecto (ETM) es en general el tratamiento de elección con vistas a la curación. Dicha cirugía toma como margen de resección a la FMR, con el fin de realizar la escisión completa del recto afectado y el mesorrecto circundante, el cual incluye todas las estructuras vasculares y linfáticas que lo atraviesan3. Por dicha razón, cobra importancia la capacidad de identificar a la FMR que nos otorga la RM de alta resolución, así como también la posibilidad de evaluar su compromiso por parte del tumor11. En la tabla 2 se exponen las circunstancias en las que la FMR se considera comprometida, tomando esos casos como margen circunferencial de resección (MCR) positivo (Fig. 13) y contraindicando por ende al tratamiento quirúrgico, a la vez que por sí mismo es un factor pronóstico de recurrencia local, metástasis a distancia y mal pronóstico8,12,13.
Tabla 2. Criterios de margen circunferencial de resección comprometido (MCR+)
| La presencia de uno o más de los siguientes: |
| – Tumor |
| – Depósito tumoral |
| – Estructura vascular invadida por tumor |
| – Ganglio linfático |
| En cualquiera de las siguientes localizaciones: |
| – En contacto con la FMR |
| – A menos de 1 mm de la FMR |
| – Extendiéndose a través de la FMR |
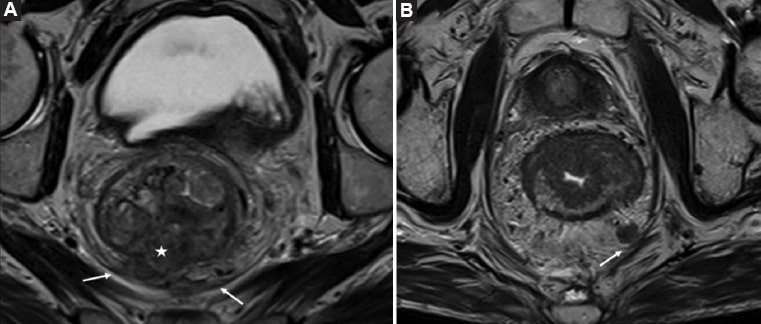
Figura 13. Compromiso del MCR. A: Imagen axial oblicua angulada en forma perpendicular al eje tumoral longitudinal en el recto superior, donde se observa una lesión tumoral (estrella blanca), que se extiende más allá de la muscular propia y contacta con la FMR (flecha blanca). B: Se observa una adenopatía localizada en contacto con la FMR (flecha blanca).
Estadificación del cáncer de recto inferior
Poder describir el compromiso de las diferentes partes del esfínter anal es determinante para la elección de tratamiento quirúrgico por parte del cirujano. Aquellos tumores de recto inferior sin compromiso esfinteriano son factibles de cirugía de ETM con conservación del esfínter, mientras que el compromiso de cualquiera de los elementos que lo conforman es determinante de cirugía con resección total o parcial del esfínter. Por dicha razón, debe analizarse la extensión lateral tumoral determinando: a) la relación de la lesión con los músculos elevadores del ano; b) la presencia/ausencia de componente tumoral en el espacio interesfinteriano; c) la presencia/ausencia de invasión del esfínter anal externo, y d) determinar la existencia de invasión a órganos vecinos. Teniendo como base esta información, se desarrolló una estadificación que complementa el TNM en los casos de compromiso del recto inferior8,14 (Fig. 14 y Fig. 15).
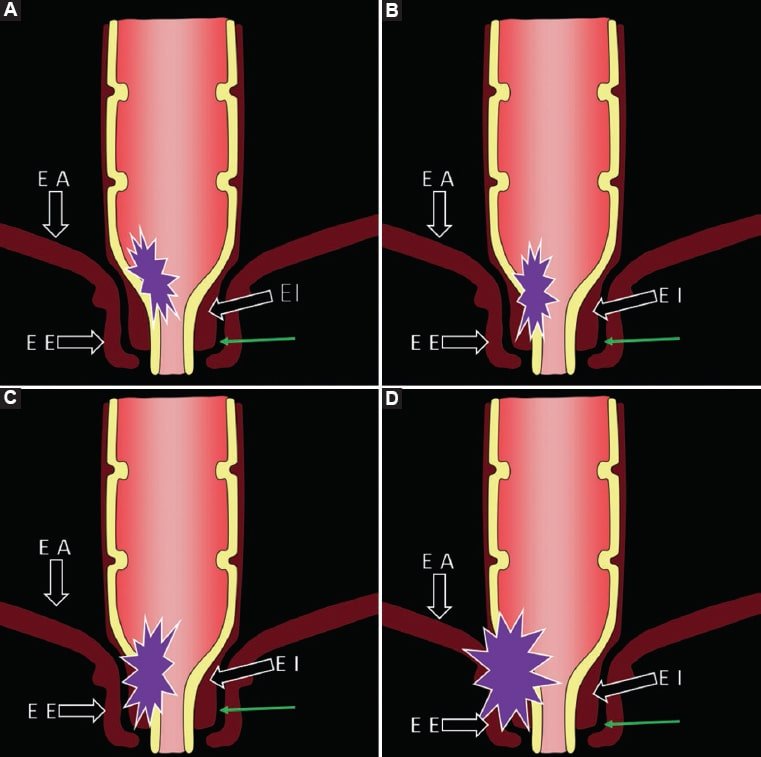
Figura 14. Representación gráfica de los diferentes estadios de compromiso del canal anal. A: Estadio 1: el tumor se limita a la pared rectal. B: Estadio 2: el tumor se extiende comprometiendo la capa muscular del esfínter interno (EI). C: Estadio 3: el tumor invade el espacio interesfinteriano (flecha verde) y se encuentra a 1 mm o menos del músculo elevador del ano (EA). D: Estadio 4: el tumor invade al esfínter anal externo (EE) y se encuentra a menos de 1 mm o incluso más allá del EA, independientemente de si existe o no invasión de órganos vecinos.
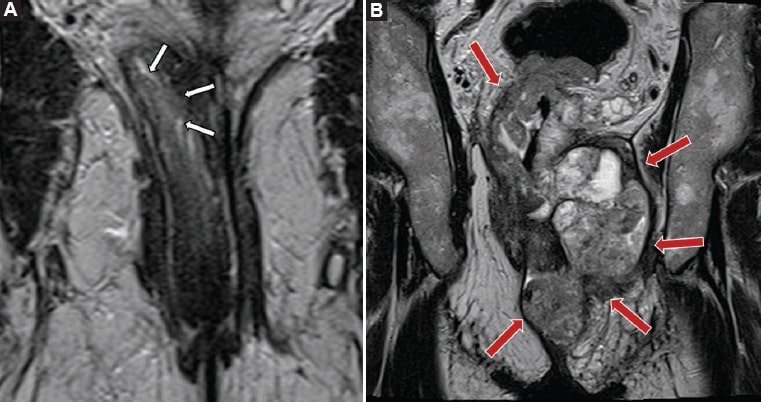
Figura 15. Ejemplos de diferentes grados de compromiso del canal anal. A: Imagen potenciada en T2 obtenida en el plano coronal siguiendo el eje coronal del canal anal, de un paciente con un tumor que afecta al recto medio e inferior (flechas blancas), el cual se encuentra limitado a la pared rectal, sin compromiso del complejo esfinteriano, correspondiendo a un estadio 1. B: En este otro caso se muestra un paciente con un tumor que afecta al recto inferior, medio y superior, que invade todas las estructuras del complejo esfinteriano (flechas rojas), correspondiendo a un estadio 4.
Estadificación N
El estadio N está determinado por la cantidad de nódulos linfáticos regionales comprometidos, considerándose: N1 el compromiso de uno a tres nódulos y N2 el de cuatro o más. En la tabla 3 se observan los criterios de sospecha de malignidad de los nódulos linfáticos1–3. Los nódulos linfáticos regionales son aquellos que se ubican a nivel de la FMR (incluyen presacros, mesentéricos inferiores y mesentéricos sigmoides), ilíaco interno y obturadores2,3. Por su parte, son considerados nódulos no regionales los ilíacos externos, ilíacos comunes e inguinales (M1) (Fig. 16). No obstante, los inguinales son considerados regionales en los casos de compromiso distal del canal anal (Fig. 17)3.
Tabla 3. Criterios para estadificación ganglionar
| Criterios morfológicos de sospecha |
|---|
| – Forma redondeada |
| – Bordes irregulares |
| – Heterogeneidad de señal |
| Criterios de nódulo maligno |
| – Diámetro del eje menor ≥ 9 mm |
| – Diámetro del eje menor 5-8 mm + 2 criterios morfológicos de sospecha |
| – Diámetro del eje menor < 5 mm + 3 criterios morfológicos de sospecha |
| – Nódulos de contenido mucinoso sin importar el tamaño |
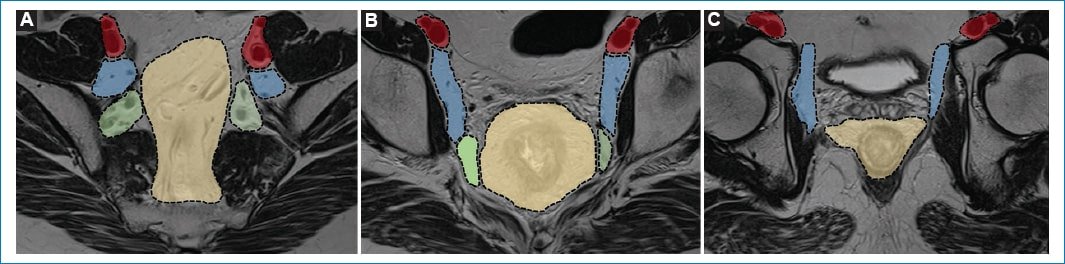
Figura 16. Grupos ganglionares: imágenes potenciadas en T2 en el plano axial oblicuo de la pelvis, siguiendo el eje longitudinal del tumor en tres niveles: cefálico (A) , medio (B) y caudal (C) . Con diferentes colores se representan los distintos grupos ganglionares: ganglios mesorrectales (color amarillo), ganglios ilíacos internos (color verde), ganglios obturadores (color azul) y ganglios ilíacos externos (color rojo).
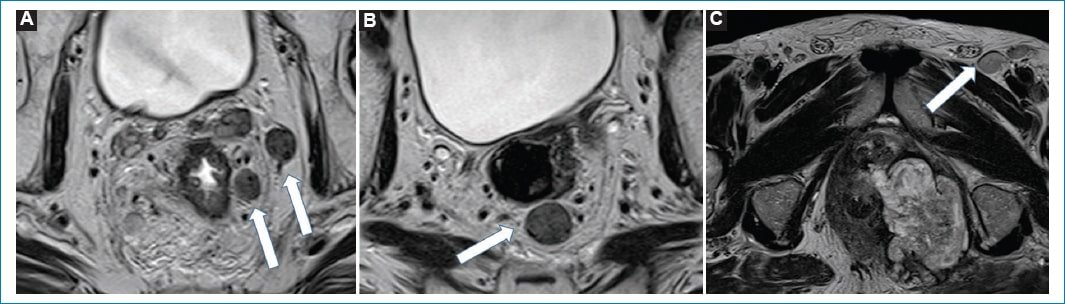
Figura 17. Compromiso ganglionar. A y B: Imágenes potenciadas en T2 obtenidas en el plano axial oblicuo perpendiculares al eje longitudinal del tumor de un mismo paciente, en diferentes niveles, donde se observan estructuras ganglionares que adquieren forma redondeada, de aspecto levemente heterogéneo y de un diámetro superior a 9 mm (flechas blancas) en su eje menor compatibles con adenopatías mesorrectales. C: Imagen potenciada en T2 axial oblicua obtenida en forma perpendicular al eje longitudinal del canal anal, donde se observa una estructura ganglionar de forma redondeada y con un diámetro superior a 9 mm (flecha blanca).
Invasión vascular extramural
La invasión vascular extramural (IVEM) hace referencia a la presencia de células tumorales dentro de estructuras vasculares más allá de la muscular propia rectal3, siendo la RM el único método por imágenes comprobado con la capacidad de detectarla (Fig. 18 y Fig. 19)8,15. Se estima que está presente en hasta la mitad de los casos de cáncer rectal y es un factor de riesgo independiente de recurrencia local y a distancia, y un indicador de mal pronóstico9,16,17. La figura 18 expone la diferente clasificación de IVEM y en la figura 19 se exponen algunos ejemplos.
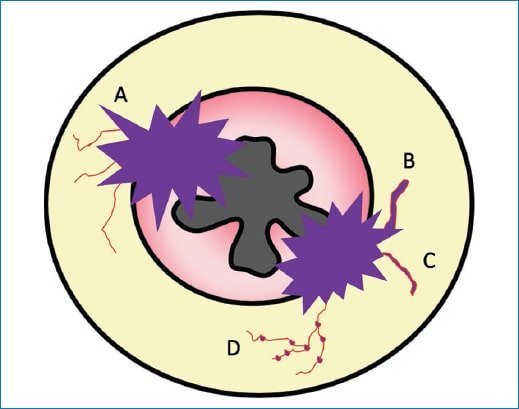
Figura 18. Representación gráfica de los diferentes tipos de IVEM. A; Vasos de calibre normal y sin cambios en su intensidad de señal, ubicados próximos al tumor. B: Vasos dilatados con cambios en su intensidad de señal interna. C: Vasos de calibre normal, pero con alteración de su intensidad de señal.
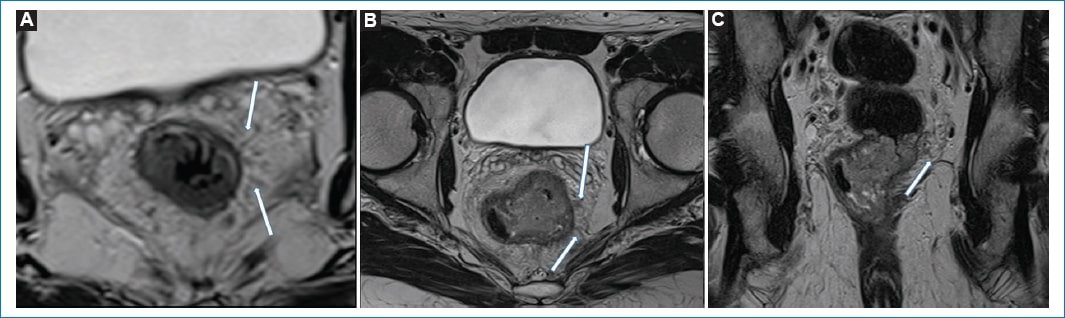
Figura 19. Ejemplos de IVEM. A: Imagen potenciada en T2 obtenida en el plano axial oblicuo perpendicular al eje longitudinal tumoral, donde se observan estructuras vasculares de calibre conservado (flechas blancas). B y C: Imágenes potenciadas en T2 axial oblicuo y coronal longitudinal al canal anal, donde se constatan estructuras vasculares levemente engrosadas, con cambios en su intensidad de señal (flechas blancas) compatibles con IVEM. D: Vasos irregulares con dilataciones nodulares, secundarias a la presencia tumoral.
Conclusión
La RM de pelvis de alta resolución es el mejor método para la caracterización de la anatomía rectal y, por ende, para la identificación de patología orgánica a este nivel. Asimismo, dicha capacidad nos permite la correcta identificación de las estructuras comprometidas para la consiguiente estadificación tumoral y para determinar los factores de buen o mal pronóstico.
Agradecimientos
Los autores agradecen a la Dra. María Inés Wulf, de Fundación Científica del Sur, por su colaboración en el presente trabajo.
Financiamiento
Los autores declaran no haber recibido financiamiento para este estudio.
Conflicto de intereses
J. Docampo es miembro del comité editorial de la Revista Argentina de Radiología. Los otros tres autores declaran no tener conflictos de intereses.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. Los autores han seguido los protocolos de confidencialidad de su institución, han obtenido el consentimiento informado de los pacientes, y cuentan con la aprobación del Comité de Ética. Se han seguido las recomendaciones de las guías SAGER, según la naturaleza del estudio.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que sí han utilizado inteligencia artificial generativa. Se utilizó software de inteligencia artificial (ChatGPT) solamente como ayuda para la traducción del resumen al inglés.