Introducción
Los nódulos tiroideos (NT) son una entidad común dentro de la práctica clínica. Se han reportado tasas de hallazgos incidentales de hasta un 40%, de los cuales el 5% tiene un comportamiento maligno (Fig. 1)1,2. Aunque la mayoría de los NT son benignos, poder diferenciarlos de neoplasias de manera prematura es fundamental para un pronto tratamiento3.
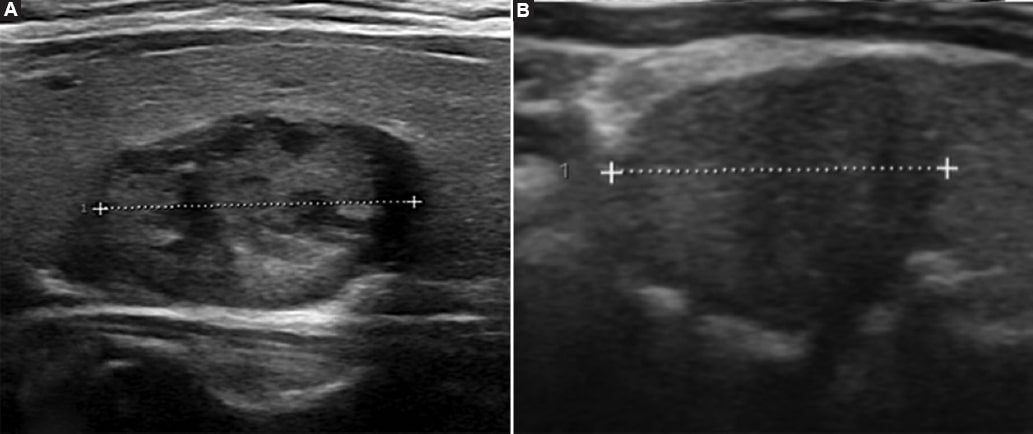
Figura 1. Ecografía, planos axiales NT confirmados por biopsia. (A) NT benigno (sólido, isoecoico, más ancho que alto sin microcalcificaciones). (B) NT maligno (cáncer papilar de tiroides) sólido, hipoecoico de bordes irregulares.
La Asociación Americana de Tiroides (ATA, American Thyroid Association) ha definido los NT como lesiones discretas dentro de la glándula tiroides, radiológicamente distintas del parénquima tiroideo circundante1,3,4. La prevalencia detectada por ecografía para NT en ecografía dirigida alcanza un 76% en población adulta, hallazgos que se correlacionan con la prevalencia reportada en cirugía y autopsias con valores de hasta el 65%5–8. Aunque los NT pueden causar disfunción tiroidea y síntomas compresivos, su real importancia se encuentra en la necesidad de excluir el cáncer de tiroides9–11.
La ecografía es el método de imagen de elección para el abordaje de NT, ya que proporciona información sobre las características propias del NT, permite guiar biopsias y realizar seguimiento de ser necesario, superando otros métodos diagnósticos como la tomografía y la resonancia magnética12,13.
Existen diferentes escalas de riesgo en la valoración de NT: la escala ATA (desarrollada por la Sociedad Americana de Tiroides) y la escala ACR TI-RADS (iniciativa del Colegio Americano de Radiología [American College of Radiology] con base en el Thyroid Imaging Reporting & Data System)13,14. Las escalas ACR TI-RADS 2017 y ATA presentan una sensibilidad del 81 y 95% y una especificidad del 79 y 73% respectivamente según lo reportado en la literatura15.
La biopsia es la herramienta más precisa para el diagnóstico de cáncer de tiroides, el estudio histológico se puede realizar mediante biopsia por aguja fina (BACAF) (Fig. 2) o TRUCUT15. Un estudio llevado a cabo por Andrew et al. demostró una sensibilidad mayor de la BACAF sobre la biopsia TRUCUT16. La Sociedad Coreana de Radiología Tiroidea no pudo comprobar superioridad del TRUCUT frente a la BACAF8,16.
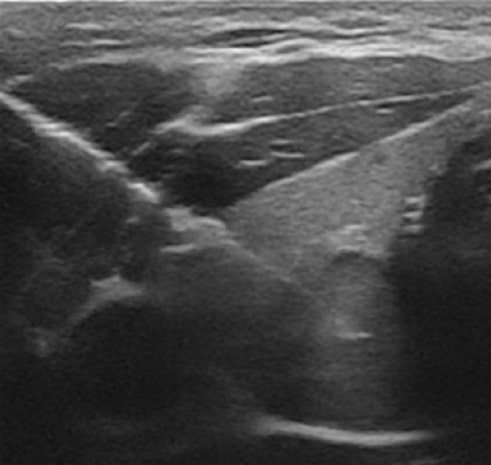
Figura 2. Ecografía, plano axial. Biopsia de nódulo tiroideo por aguja fina.
De acuerdo con datos del Centro para el Control y la prevención de enfermedades (CDC, Centers for Disease Control and Prevention), cada año alrededor de 12.000 hombres y 33.000 mujeres presentan cáncer de tiroides, y alrededor de 900 hombres y 1.000 mujeres mueren por la enfermedad3,17. El propósito de este estudio es comparar el rendimiento diagnóstico de las escalas de riesgo ATA vs. ACR TI-RADS 2017 para la valoración de pacientes con NT evaluados por ecografía.
Método
Realizamos un estudio ambispectivo en el cual fueron incluidos 322 pacientes mayores de 18 años que consultaron al Servicio de Radiología del Hospital Militar Central, en Bogotá, Colombia, durante enero de 2018 a enero de 2022. Los criterios de inclusión para nuestra muestra de estudio fueron los siguientes: a) pacientes mayores de 18 años con reporte definitivo de patología de NT biopsiados por BACAF y reportado por el sistema Bethesda de citopatología, y b) sujetos llevados a cirugía por NT con previa ecografía diagnóstica clasificados por las escalas ACR TI-RADS 2017 y ATA 2015 con diagnóstico definitivo reportado por sistema Bethesda. Los pacientes con biopsia obtenida por TRUCUT, resultado de biopsia no concluyente o no satisfactoria (Bethesda I) se excluyeron del estudio.
Las imágenes se obtuvieron en ecógrafo Simens Acuson Juniper p500 con transductor de alta frecuencia (7MHZ) en precept para tiroides. La adquisición la llevó a cabo un radiólogo experto en el tema con diez años de entrenamiento en el área. Posteriormente, se procedió a clasificar los NT por las escalas ATA y ACR TI-RADS. Las variables que se tuvieron en cuenta al momento de la estratificación de los nódulos fueron las siguientes: ecogenicidad (establecida con respecto al parénquima tiroideo circundante), composición (según el componente mayoritario del nódulo, más del 50%), forma (medidas en eje mayor transverso, anteroposterior y longitudinal), tamaño (basado en la medida de su eje mayor), borde (límites y formas del nódulo con respecto al parénquima) y calcificaciones (presencia de focos ecogénicos al interior o en la periferia del nódulo). Se consideraron ganglios anormales aquellos con diámetro en eje corto > 10 mm o los que presentaban engrosamiento cortical (> 3 mm) focal o asimétrico, morfología redondeada o pérdida del hilio graso central.
Se estableció el valor de TI-RADS de 1 a 5 y el valor de ATA como benigno, muy baja sospecha, baja sospecha, sospecha intermedio o alto sospecha con su respectivo criterio de cada escala para la realización de BACAF.
Posteriormente, se usó el sistema de historias clínicas para el acceso al reporte de biopsias de patología de los pacientes con sistema Bethesda considerando las siguientes categorías: I no diagnóstico/insatisfactorio, II benigno, III atipia o lesión folicular de significado incierto, IV neoplasia folicular o sospechoso para neoplasia folicular, V sospechoso de malignidad y VI maligno.
Se almacenó la información de las variables en una base de datos en Excel para Windows en la cual se codificaron por números consecutivos los pacientes para preservar el anonimato. Se usó la regresión logística múltiple con desenlace 1 (malignidad), 0 (no malignidad), para estimar la sensibilidad y especificidad de ambos sistemas y los factores que explican la presencia de riesgo. Los valores se expresaron en promedio para variables continuas y porcentajes para variables categóricas. Se usó la prueba de chi cuadrado para ver la asociación de resultados entre las variables categóricas. La t de Student se aplicó para valorar la diferencia entre variables continuas. Los datos se analizaron con el software estadístico STATA V16.1.
Resultados
De los 322 pacientes con NT se excluyeron 94 por resultados de citología insatisfactoria (29,1%) y 11 por no contar con registro de imágenes en el sistema de almacenamiento. Finalmente, 217 NT fueron evaluados obteniendo su resultado de patología y citología mediante BACAF en 215 casos y dos por tiroidectomía.
De los NT seleccionados, 201 de los pacientes identificados fueron mujeres (92%), con una edad promedio de 52,8 y 16 fueron hombres (8%) con una edad promedio de 54,8 años (Tabla 1).
Tabla 1. Variables demográficas
| Pacientes | Sexo | Promedio de edad (DE) | Intervalo de edad (años) | NT malignos |
|---|---|---|---|---|
| 16 | Hombre | 54,8 (9,42) | 32-68 | 6 |
| 201 | Mujer | 52,8 (13,81) | 18-88 | 40 |
|
DE: desviación estándar |
||||
En referencia a las características ecográficas de los NT analizados, la composición sólida (91,2%) (Fig. 3), los nódulos hipoecoicos (77,4%) (Fig. 4) y la forma más ancha que alta (84,3%) (Fig. 5) fueron los hallazgos más frecuentes encontrados en cada una de las variables valoradas.
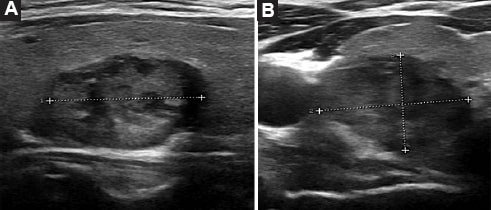
Figura 3. Ecografía, planos sagital y axial. (A y B) NT sólido en diferentes pacientes.
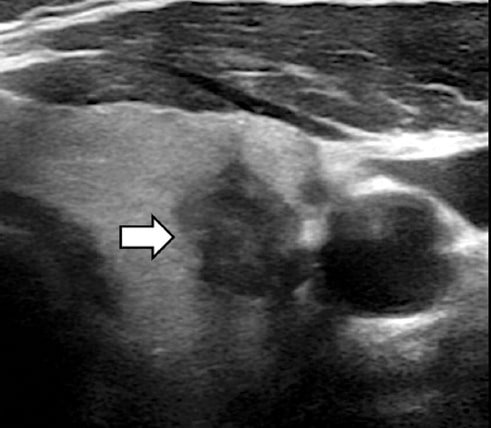
Figura 4. Ecografía, plano axial NT hipoecoico (flecha blanca).
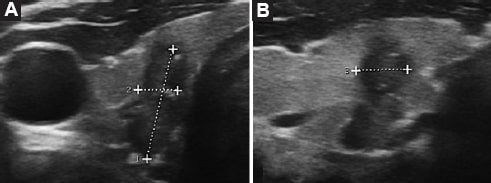
Figura 5. Ecografía, planos axial (A) y sagital (B). NT más alto que ancho.
Con respecto al tamaño, los NT inferiores a 14 mm fueron los más comúnmente observados. Las microcalcificaciones estuvieron presentes en el 12,9% de los casos (Fig. 6) y las macrocalcificaciones en el 13,8% de los NT. Se reportaron ganglios anormales asociados hasta en el 9,2% de los casos. La información de las características ecográficas comparando NT benignos y malignos se presentan en la tabla 2.
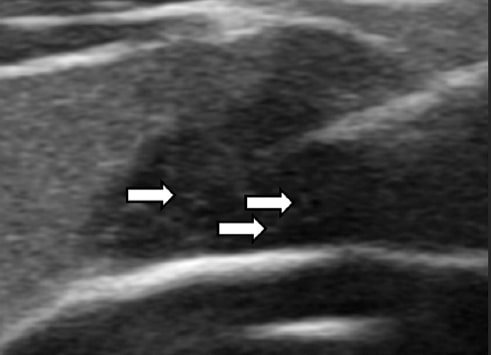
Figura 6. Ecografía, plano axial. NT con microcalcificaciones (flechas blancas).
Tabla 2. Características ecográficas de los NT.
| Variables | Benigno (%) | Maligno (%) |
|---|---|---|
| Ecogenicidad | ||
| Hipoecoico | 129 (75,4%) | 39 (84,7%) |
| Isoecoico | 32 (18,7%) | 7 (15,3%) |
| Hiperecoico | 10 (5,8%) | – |
| Composición | ||
| Quística | 5 (2,9%) | – |
| Solida | 152 (88,8%) | 46 (100%) |
| Espongiforme | 1 (0,5%) | – |
| Mixta | 13 (7,6%) | – |
| Forma | ||
| Más alto que ancho | 15 (8,7%) | 19 (41,3%) |
| Más ancho que alto | 156 (91,2%) | 27 (58,6%) |
| Tamaño | ||
| 0-1,4 cm | 110 (64,3%) | 33 (71,7%) |
| 1,5-2,4 cm | 34 (19,8%) | 12 (26%) |
| > 2,5 cm | 27 (15,7%) | 1 (2,1%) |
| Bordes | ||
| Lisos | 153 (89,4%) | 25 (54,3%) |
| Mal definidos | 15 (8,7%) | 12 (26%) |
| Lobulados/irregulares | 3 (80,1%) | 9 (19,5%) |
| Extensión extratiroidea | – | – |
| Calcificaciones | ||
| Sin calcificaciones | 137 (80,1%) | 22 (48%) |
| Microcalcificaciones < 1 mm | 16 (9,3%) | 12 (26%) |
| Macrocalcificaciones > 1 mm | 18 (1,7%) | 12 (26%) |
| Ganglios anormales | 2 (1,1%) | 20 (43,4%) |
De los 217 NT, 171 fueron benignos y 46 malignos (carcinoma papilar de tiroides 89%). Otros diagnósticos asociados a NT malignos fueron tiroiditis (10,8%) y bocio tiroideo (4,3%). El promedio de edad de pacientes con NT malignos fue de 50,7 años y para NT benignos fue de 53,6 años.
Al comparar entre las variables analizadas por ecografía y la histología de los NT malignos vs. benignos se encontraron diferencias significativas en la forma (55,9 vs. 44,1%; p = 0,000) y la presencia de microcalcificaciones (26,1 vs. 9,4%; p = 0,000). También se observaron diferencias significativas en aquellos NT malignos asociados a la presencia de ganglios anormales (56,5 vs. 43,5%; p = 0,000). Los bordes irregulares fueron más frecuentes en los NT malignos (75 vs. 25%; p = 0,000). Según la ecogenicidad, la mayoría de los NT malignos con respecto a los benignos fueron hipoecoicos (84,4 vs. 75,4%; p = 0,188), sin diferencias estadísticamente significativas entre los grupos. Tampoco se encontraron diferencias significativas entre los NT en relación con su edad de presentación (54,8 vs. 52,8 años; p = 0,200) y la vascularidad (84,4 vs. 75,4%; p = 0,188) (Fig. 7). Una limitación en nuestro estudio fue que en esta variable no todos los NT evaluados contaban con análisis Doppler.
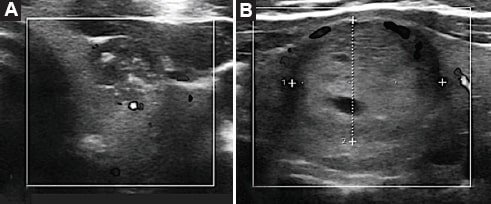
Figura 7. Ecografía, planos axiales NT confirmados por biopsia. NT maligno (A) y NT benigno (B) no vascularizados.
Con respecto al análisis de resultados sobre el rendimiento diagnóstico de la escala ACR TI-RADS, se consideró como positivos los nódulos clasificados con moderado y alto riesgo de sospecha (TI-RADS ≥ 4) y negativo aquellos categorizados como sospecha leve (TI-RADS ≤ 3) y clasificaciones inferiores. Los resultados para el rendimiento de ACR TI-RADS fueron los siguientes: sensibilidad 95,65%, especificidad 26,32%, valor predictivo positivo (VPP) 25,88% y valor predictivo negativo (VPN) 95,74% (IC 95%). En la escala de riesgo ATA se consideraron como positivos aquellos NT con sospecha intermedia y alta (ATA ≥ 4) y negativos aquellos NT con leve sospecha (ATA ≤ 3) y categorías inferiores. Los resultados de rendimiento diagnóstico para ATA fueron sensibilidad 97,83%, especificidad 25,73%, VPP 26,16% y VPN 97,78% (IC 95%). Los parámetros se establecieron basados en los riesgos de malignidad calculados para el estudio.
El riesgo de malignidad calculado en cada categoría para ACR TI-RADS y ATA se presentan en la tabla 3.
Tabla 3. Riesgo de malignidad NT escalas ACR-TIRAD y ATA
| ACR TI-RADS | #NT | #NT malignos | Riesgo de malignidad (%) |
|---|---|---|---|
| 5 | 79 | 34 | 43% |
| 4 | 91 | 10 | 11% |
| 3 | 43 | 2 | 4,6% |
| 2 | 3 | 0 | 0% |
| 1 | 1 | 0 | 0% |
| ATA | #NT | #NT malignos | Riesgo de malignidad (%) |
| 5 | 54 | 29 | 53% |
| 4 | 118 | 16 | 16% |
| 3 | 41 | 1 | 2,3% |
| 2 | 4 | 0 | 0% |
| 1 | 0 | 0 | 0% |
|
ATA: escala de riesgo en la valoración de NT de la American Thyroid Association; ACR TI-RADS: escala de riesgo en la valoración de NT (Thyroid Imaging Reporting & Data System) del American College of Radiology. |
|||
Discusión
De acuerdo con lo reportado en la literatura, nuestro estudio evidenció una mayor presentación de cáncer de tiroides en población femenina, siendo el 92% de los casos en el grupo de estudio. También se encontró que el carcinoma papilar de tiroides fue la variante histológica más prevalente en la muestra, como se ha informado en la literatura.
Nuestro estudio llevó a cabo la comparación del rendimiento diagnóstico entre dos escalas de riesgo para predicción de malignidad. En nuestra investigación, calculamos una sensibilidad para ACR TI-RADS del 95,6% y una especificidad del 26,3%; para ATA estimamos una sensibilidad del 97,83% y una especificidad del 25,73%. Nuestros hallazgos sugieren que ambas escalas de riesgo tienen adecuado rendimiento para establecer el riesgo de malignidad por medio de ecografía con valores de sensibilidad y VPN mayores al 90% y un valor ligeramente más alto de sensibilidad en la escala ATA. Nuestros resultados son comparables con los reportados previamente en la literatura; un estudio llevado a cabo por Chng et al. en Singapur describió una sensibilidad del 98% para ATA y el 90% para TI-RADS y VPN para ambas escalas superiores al 90%18. Los hallazgos descritos podrían variar, dado que en nuestro modelo no incluimos los NT de baja sospecha dentro del grupo de NT malignos en la escala ATA debido al bajo riesgo de malignidad calculado en nuestro estudio. Sin embargo, nuestros valores son más cercanos a los reportados en el estudio de Yoon, en el cual analizaron 1.293 NT y determinan el mismo valor de corte en las escalas de riesgo para definir malignidad. Los autores concluyen para ACR TI-RADS una sensibilidad del 97,4% y especificidad del 29,3%, y para ATA una sensibilidad del 95,5% y especificidad del 37,4%19.
El riesgo de malignidad para los nódulos categorizados como alta sospecha en nuestro estudio (ACR TI-RADS 43%, ATA 53%) fue menor al descrito en la literatura por las guías ACR TI-RADS y ATA (87,5%, > 70%), hallazgos que podrían estar asociados a la cantidad de NT examinados en nuestra muestra18. Encontramos valores de referencia más cercanos en la investigación de Yoon, en la cual informan un riesgo de malignidad para ATA del 58%, aunque se observa un valor significativamente menor con respecto a la escala ACR TI-RADS, del 92%, resultados que podrían relacionarse con la variabilidad interobservador al momento de clasificar los nódulos en ACT TI-RADS categorías 4 y 519.
De acuerdo con la literatura, nuestro trabajo encontró que aquellos NT que presentaban bordes irregulares, forma más alta que ancha y presencia de microcalcificaciones se asociaban más comúnmente a los NT malignos (p < 0,05). Un metaanálisis llevado a cabo por Remonti et al. acerca de las características en ultrasonido de los NT y el riesgo de carcinoma concluye que las características ecográficas asociadas con un mayor riesgo y probabilidad de malignidad postest fueron una forma más alta que ancha, ausencia de elasticidad, presencia de microcalcificaciones y márgenes irregulares20. Una investigación llevada a cabo en Grecia que incluyó 108 pacientes demostró asociación entre la presencia de calcificaciones y NT malignos, particularmente en pacientes jóvenes21. Las calcificaciones detectadas por ecografía representan un factor de riesgo de malignidad, pero tiene una utilidad limitada como único marcador de malignidad22.
El margen irregular en un NT sugiere infiltración maligna del parénquima tiroideo adyacente, nuestro trabajo observó diferencias significativas en aquellos NT malignos de bordes irregulares; sin embargo, la sensibilidad reportada de márgenes irregulares varía ampliamente (7-97%), debido a que algunos carcinomas papilares de tiroides pueden tener un margen bien delimitado23. Siebert en su investigación desarrollada en el Departamento de Radiología de la Universidad de Stanford, el cual incluyó 1.181 pacientes, afirmó que los bordes irregulares en su estudio fueron altamente predictores de carcinoma papilar de tiroides con una sensibilidad del 67,4% y especificidad del 78,3%24.
El patrón más común de vascularidad en NT malignos es una marcada vascularidad intrínseca en la parte central de la lesión23. En EE.UU., Frates et al. obtuvieron imágenes en Doppler color de 254 NT que iban a ser llevados a BACAF y demostraron que el 14% de los nódulos sólidos no hipervasculares eran malignos23,25.
En un estudio retrospectivo desarrollado por Moon, en el cual evaluaron los criterios ecográficos de diagnóstico en 831 NT, describieron que los nódulos hipoecoicos mostraban mayor sensibilidad en contexto de malignidad20,26. En nuestro estudio esta característica no fue estadísticamente significativa.
Con respecto al tamaño de los NT, el estudio de Hakami et al. encontró que el riesgo de malignidad más alto fue observado en nódulos < 2 cm, con una mayor prevalencia y un p < 0,00127. Cuando compararon con NT mayores a 2 cm, no se encontraron diferencias en las tasas de malignidad27. Su estudio sugiere que el tamaño de los NT de hasta 2 cm se asocia con un mayor riesgo de cáncer de tiroides, pero un crecimiento de más de 2 cm ya no influye en el riesgo de cáncer27. Nuestra investigación encontró que el 82% de los NT malignos se encontraba entre 1 y 2 cm, con un promedio de 14,9 mm.
Es importante recordar que el tamaño del NT como variable única no ayuda a predecir o descartar malignidad. Papini reveló en su estudio de 325 NT que la selección para BACAF de NT solo por tamaño resultó en la detección del 61% de los cánceres de tiroides, mientras que al usar las demás variables en escalas de riesgo se alcanzó un 87%23,28.
El consenso de la Sociedad de Radiología en Ecografía para el manejo de NT y la Sociedad Americana de Endocrinología Clínica recomienda la realización de BACAF para nódulos mayores a 10 mm29,30. Aunque la BACAF es una técnica segura, sus tasas de resultado diagnóstico son variables en la literatura (0,4-40,7%)31. En nuestro estudio tuvimos un total de 94 biopsias no diagnósticas (29,1%). Consideramos como posibles causas los tamaños del NT biopsiados con resultado insatisfactorio, que en nuestro trabajo tuvo un promedio de 11,57 mm y la composición quística de algunos NT. Dos estudios publicados por Baier y Grani reportan como causa de resultados no diagnósticos el tamaño del nódulo < 10 mm, la dominancia quística (Fig. 8) y la edad del paciente mayor a 75 años32,33. Es importante mencionar que aunque la literatura no recomiende la biopsia para lesiones menores a 10 mm, es necesario realizar seguimiento ecográfico o considerar la biopsia junto a un equipo multidisciplinario experto, dado que el 71% de los NT malignos detectados en nuestro estudio se encontraban en el grupo de tamaño inferior a 14 mm y el 34% de los NT fueron inferiores a 10 mm.
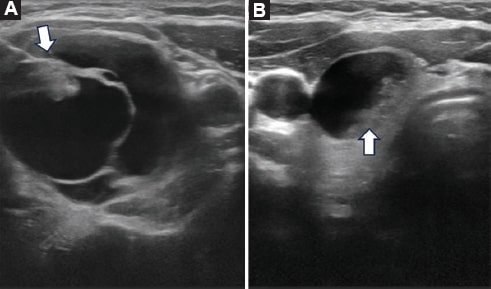
Figura 8. Ecografía, planos axiales. A y B: NT predominantemente quísticos con componente sólido sospechoso (flechas blancas).
Las limitaciones de nuestro estudio incluyen el número de pacientes involucrados y la obtención de la gran mayoría de los resultados por estudio citológico; sin embargo, nuestros resultados demuestran un adecuado grado de correlación con respecto a la literatura mundial reportada.
Conclusiones
Los resultados de nuestra investigación indican que las escalas de riesgo ACT TI-RADS y ATA tienen una alta sensibilidad como métodos de categorización en el estudio de NT. En el presente estudio observamos que los NT con microcalcificaciones, más altos que anchos y de bordes irregulares se asociaban más a NT malignos, con diferencias estadísticamente significativas con respecto a los NT benignos. Encontramos que la mayoría de los pacientes con NT malignos eran de sexo femenino y el carcinoma papilar de tiroides fue la variante histológica más común entre ellos.
Por otra parte, según los resultados de la investigación se sugiere la realización de BACAF a los NT sospechosos con un diámetro mayor a 10 mm, siempre y cuando el paciente no presente factores de riesgo. Es necesario realizar seguimiento ecográfico o considerar biopsia para aquellos NT sospechosos menores a 10 mm si se cuenta con un servicio multidisciplinario experto y se decide una conducta.
Financiamiento
Los autores declaran que no se recibió financiamiento para el desarrollo del estudio.
Conflicto de intereses
Los autores declaran que no presentan conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. Los autores han seguido los protocolos de confidencialidad de su institución, han obtenido el consentimiento informado de los pacientes, y cuentan con la aprobación del Comité de Ética. Se han seguido las recomendaciones de las guías SAGER, según la naturaleza del estudio.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.