Estimados Editores:
Muchos de los fármacos utilizados en la práctica clínica habitual pueden inducir toxicidad pulmonar, hecho que debemos de tener en cuenta cuando nos enfrentamos al diagnóstico de una enfermedad difusa del parénquima pulmonar.
El objetivo de la presentación es recordar la existencia de toxicidad pulmonar secundaria, la importancia de poder reconocerla en la tomografía computada (TC) y reportarla para el adecuado seguimiento del paciente, y así evitar su progresión.
Presentamos el caso de un paciente de sexo masculino de 68 años con antecedentes de cáncer de recto con metástasis hepáticas reportadas en TC de estadificación (Fig. 1).
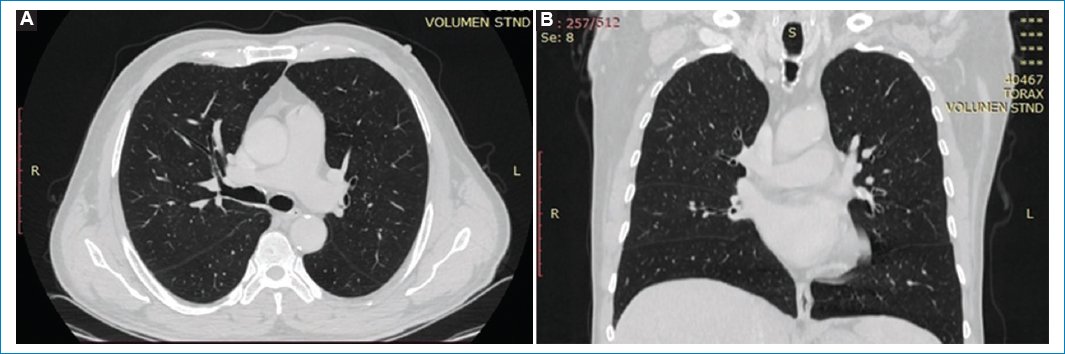
Figura 1. TC de tórax en ventana para evaluar parénquima pulmonar, (A) corte axial y (B) corte coronal. No se identifican particularidades en el pulmón.
Inicia tratamiento oncoespecífico de primera línea (seis ciclos de oxaliplatino + capecitabina), además de la cirugía (hemicolectomía derecha).
En abril de 2023, luego de completar su quinto ciclo de quimioterapia (cuatro meses), debido a la presencia de progresión local, confirmada por resonancia magnética de abdomen y pelvis, inicia tratamiento neoadyuvante con radioterapia (DT50 Gy en 28 fracciones).
En junio de 2023 el paciente intercurre con elevación de los marcadores tumorales y un cuadro de radiodermitis en región perineal grado 1, razón por la cual se decide rotar el esquema terapéutico a irinotecán + cetuximab cada 15 días. Incide con efectos no deseados: anemia con requerimiento de transfusión de hemoderivados y neutropenia, por lo que se disminuye la dosis de los fármacos oncoespecíficos, con buena tolerancia, esquema que recibe durante cuatro ciclos, con última administración en agosto del mismo año.
Posteriormente presenta disnea a esfuerzos sin tos, desaturación por oximetría de pulso asociado a rales crepitantes finos bibasales, negando equivalentes febriles y otra sintomatología acompañante. Se decide su ingreso hospitalario con el fin de buscar la causa y reestadificar la enfermedad de base.
Se realizan nuevos estudios de imágenes, en los cuales se observa enfermedad oncológica avanzada.
La TC de tórax actual demuestra infiltrados reticulares en ambos parénquimas pulmonares, acompañado de múltiples pequeñas imágenes quísticas de disposición subpleural conformando “patrón en panal de abejas” con predominio de ambos lóbulos inferiores. Se acompaña de bronquiectasias cilíndricas en ambos parénquimas, así como también infiltrado intersticial en vidrio esmerilado, siendo más evidente en las bases. Estos hallazgos se interpretaron como neumonía intersticial usual, lo cual no se observaba en estudios previos (Figs. 2 y 3).
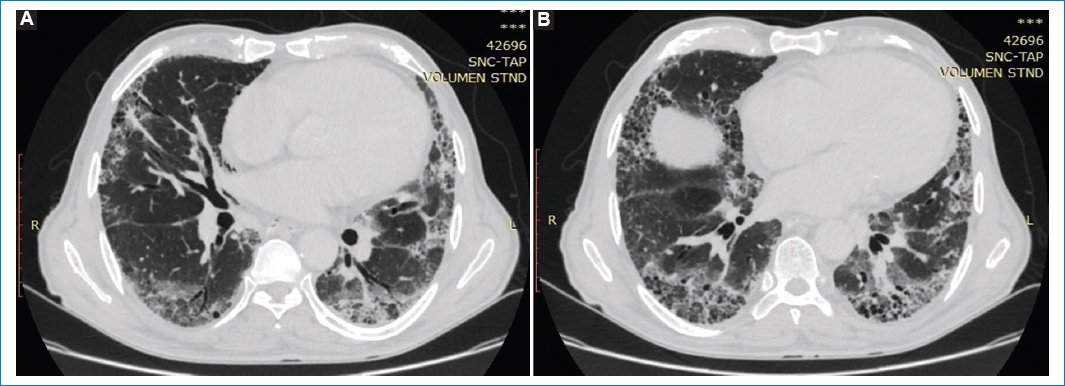
Figura 2. (A y B) TC corte axial en ventana para evaluar parénquima pulmonar, “patrón en panal de abejas” en ambos lóbulos inferiores. Se acompaña de bronquiectasias cilíndricas en ambos parénquimas.
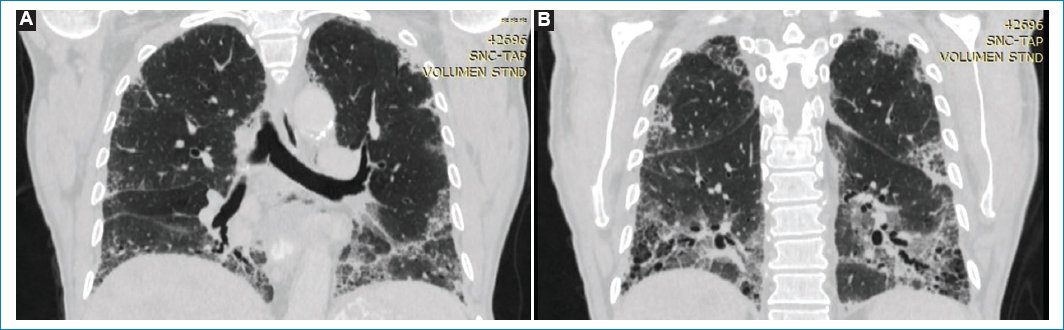
Figura 3. (A, B) TC corte coronal en ventana para evaluar parénquima pulmonar, “patrón en panal de abejas” en ambos lóbulos inferiores. Se acompaña de bronquiectasias cilíndricas en ambos parénquimas.
El término “lesión pulmonar inducida por medicamentos” (MIPI, por sus siglas en inglés) puede abarcar descriptores como la enfermedad pulmonar intersticial inducida por medicamentos y los efectos tóxicos pulmonares inducidos por medicamentos.
Muchos de los nuevos agentes asociados con la MIPI son agentes anticancerígenos o productos biológicos (medicamentos derivados de componentes de organismos vivos)1.
La MIPI puede estar impulsada por muchos mecanismos de lesión pulmonar, y en algunos casos la lesión pulmonar es multifactorial. Dentro de los mecanismos de lesión podemos ver el daño directo del ADN, las alteraciones en la señalización de las células alveolares que mejoran la apoptosis o suprimen la proliferación celular y la lesión inmunitaria mediada por células T1.
Debe sospecharse una MIPI haciendo una asociación temporal del inicio de los síntomas con el inicio de la medicación. En el contexto del tratamiento con inmunomoduladores, el tiempo de retraso medio entre el inicio del tratamiento y el desarrollo de la neumonitis es de tres meses, no obstante, este tiempo varía entre pacientes. En el caso de algunos agentes estándar, como la bleomicina y la ciclofosfamida, depende de la dosis, y la enfermedad puede manifestarse años después del inicio del tratamiento1,2.
Los pacientes pueden presentarse asintomáticos con hallazgos inexplicables en las imágenes o presentar síntomas más graves, como tos, disnea, sibilancias y fiebre.
La lesión pulmonar inducida por fármacos se puede manifestar con diferentes patrones radiológicos2,3:
- −Opacidades difusas en vidrio esmerilado (más frecuente), una lesión que involucra todos los componentes de la pared alveolar y se asocia comúnmente con el daño alveolar difuso1,2.
- −Patrón similar a la sarcoidosis.
- −Neumonía organizada. Causada por lesión de los bronquiolos y alvéolos, con tejido de granulación desarrollándose en la vía aérea terminal y extendiéndose hacia las luces alveolares. Las manifestaciones agudas más comunes incluyen opacidades en vidrio esmerilado peribroncovascular bilateral multifocal periféricas o consolidación (signo del halo invertido)2,3.
- −Nódulos centrolobulillares en vidrio esmerilado, en la literatura conocido como “patrón de neumonitis por hipersensibilidad”.
- −Patrón reticular fino. Consiste en un engrosamiento septal liso, a veces con derrame pleural. Este patrón es causado más comúnmente por la congestión linfática por edema pulmonar hidrostático y es una manifestación poco común de MIPI4.
- −Patrón fibrótico. Es causado por una lesión en la pared alveolar y las estructuras de soporte que recorren los septos interlobulillares y el intersticio intralobulillar. Los hallazgos de imagen incluyen reticulación, bronquiectasias por tracción y, en algunos casos, opacidades peribroncovasculares. Se manifiesta con menos frecuencia como neumonía intersticial usual45.
Estos patrones se superponen con otras causas de afección pulmonar frecuentes con las que hay que hacer el diagnóstico diferencial como, por ejemplo, la infección pulmonar, la dificultad respiratoria del adulto y la hemorragia alveolar. Para ello es importante sospechar esta entidad, dado que un retraso en el diagnóstico puede dar lugar a una fibrosis pulmonar irreversible y en los peores casos, al fallecimiento del paciente2.
En las imágenes, los patrones radiológicos son similares a los de las enfermedades intersticiales idiopáticas o inducidas por otros agentes y muchas veces son difíciles de diferenciar de afección como la infección, edema pulmonar o la toxicidad a la radioterapia en los pacientes oncológicos, como ya mencionamos.
Es casi siempre un diagnóstico de exclusión que se realiza con retraso y que supone un reto para el radiólogo, ya que implica la suspensión del fármaco con las consecuencias que ello puede tener en el pronóstico y el manejo del paciente.
Es fundamental distinguir entre las diversas manifestaciones pulmonares para tomar una decisión sobre la continuación o la interrupción del tratamiento, ya que existen opciones de tratamiento adicionales limitadas. Si bien toda la línea de fármacos oncoespecíficos utilizados en nuestro paciente podrían causar enfermedades pulmonares intersticiales o parenquimatosas, el uso de terapias dirigidas con anticuerpos monoclonales podría tener relación con su rápida evolución a la fibrosis pulmonar. En nuestro caso, luego del reporte de la TC, se asumió como enfermedad pulmonar asociada a drogas oncológicas, por lo que se suspendió dicho tratamiento, y al encontrarse en estadios avanzado de su enfermedad de base, se realizaron medidas de soporte y cuidados paliativos exclusivos.
Agradecimientos
Los autores agradecen a su servicio por brindarles las herramientas para desarrollarse como profesionales en la radiología, y a la institución por otorgar la posibilidad de realizar un trabajo interdisciplinario con sus colegas.
Financiamiento
Los autores declaran no haber recibido financiamiento para este estudio.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. Los autores han seguido los protocolos de confidencialidad de su institución, han obtenido el consentimiento informado de los pacientes, y cuentan con la aprobación del Comité de Ética. Se han seguido las recomendaciones de las guías SAGER, según la naturaleza del estudio.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.