Introducción
La ablación de venas pulmonares (VP) es un procedimiento recomendado y con alta tasa de éxito para el tratamiento de fibrilación auricular (FA) que no se puede prevenir o controlar con tratamiento farmacológico1,2, y que ha demostrado reducir síntomas y mejorar el pronóstico de los pacientes.
Aunque la ablación es una técnica con bajo porcentaje de complicación, puede haber complicaciones en las propias VP, cardiacas, intratorácicas o extratorácicas (en el sitio de punción)3. Existe una tasa de complicaciones graves del 2,9-3,9% que ha ido disminuyendo con la experiencia a lo largo de los años4,5. Una de las potenciales complicaciones de la ablación es la estenosis de las VP, con una incidencia del 31,4% en la estenosis leve6. No obstante, la presencia de estenosis moderada o grave (descrita como una reducción del vaso mayor del 50%) ocurre en un porcentaje de pacientes del 1-4%6,7, y grave (reducción igual o mayor al 70%) y/o con necesidad de tratamiento del 0,4-0,7%5,6,8 en las series más recientes, siendo una complicación poco frecuente pero potencialmente grave incluso a largo plazo9,10.
Actualmente la tomografía computada (TC) y la cardiorresonancia magnética (CRM) son las técnicas más empleadas7,8, basándose el diagnóstico en una reducción morfológica del diámetro, aunque la angiografía de VP se considera el método de referencia7.
En nuestro centro disponemos de una CRM previa a la ablación, ya que nos sirve para la planificación anatómica. A pesar de estar más extendido el uso de la TC 1, la CRM es similar a la TC de cara a la planificación y, además, nos aporta información sobre focos de fibrosis en la aurícula1,11.
Esta CRM previa al procedimiento también nos permite descartar la presencia de trombos en la orejuela, similar también a la TC de planificación1,12. En un metaanálisis reciente13 se ha concluido que la CRM con contraste es una herramienta comparable al método de referencia, que es la ecografía transesofágica, para descartar trombos en la orejuela previa a la ablación.
En las guías también se recomienda un estudio de imagen (TC o CRM) posterior a la ablación de VP para valorar la presencia de estenosis o fístulas1.
Ya que disponemos de una CRM previa y posterior al procedimiento, nos planteamos añadir la secuencia 4D Flow al protocolo para estudiar su contribución sumando información de flujo, hasta ahora solo disponible mediante una técnica invasiva como la angiografía.
La secuencia 4D Flow de la CRM es una secuencia volumétrica que permite analizar el flujo de cualquier estructura incluida en el estudio, independientemente de su dirección o sentido, y aporta información cualitativa, cuantitativa y morfológica.
Aunque su implantación clínica es relativamente frecuente, los parámetros de adquisición y posproceso están bien definidos14. Es una secuencia consistente, reproducible y con poca variabilidad en su análisis. Estudios previos han comprobado la utilidad de la secuencia 4D Flow en la valoración de afección valvular15,16, en shunts cardiacos17, cardiaca congénita18 y en afección aórtica19,20.
Seleccionamos esta secuencia porque forma parte de varios de nuestros protocolos de CRM y ha demostrado utilidad en el estudio de flujo en la práctica clínica habitual. Además, no tenemos constancia de estudios que evalúen el uso de la secuencia 4D Flow en las VP en el contexto de ablación, aunque sí se ha comprobado su utilidad en la trombosis venosa pulmonar tras lobectomía y la vinculación de ciertas características del flujo venoso pulmonar con la FA21,22.
Nuestro objetivo es determinar qué valor añade la secuencia 4D Flow en el contexto de ablación de VP, en cuanto a medidas de diámetro, velocidad o flujo. Nuestra hipótesis es que la inclusión de la secuencia 4D Flow nos aporta información morfológica y de flujo útil sobre las VP, previo y posterior a la ablación.
Método
Pacientes
El protocolo de este proyecto de investigación fue aprobado por el Comité de Ética del centro de referencia nacional (CEIm-FJD acta n.º 14/18) a fecha de 24 de julio de 2018. Es un estudio prospectivo, que incluyó a pacientes consecutivos (candidatos por indicación clínica a dicho tratamiento) sometidos a ablación de VP con radiofrecuencia en nuestro centro de 2018 a 2020 a los que se realizó CRM con secuencia 4D Flow antes de la ablación de VP, por protocolo para planificación de la ablación en función de los focos de fibrosis. Posteriormente, a estos pacientes se les realizó CRM con secuencia 4D Flow al menos tres meses después del procedimiento. Los pacientes firmaron el consentimiento informado y un documento que permite el uso de imágenes y datos obtenidos de la imagen para enseñanza o investigación.
Se excluyen aquellos pacientes en los que la ablación no fue realizada (tres pacientes) y aquellos en que por movimiento del paciente la secuencia 4D Flow no tenía suficiente calidad diagnóstica (dos pacientes).
Procedimiento
En todos los casos realizamos CRM con secuencia 4D Flow previa a la ablación. Se realizó el procedimiento de la clínica habitual de ablación de VP con anestesia general e intubación orotraqueal que consiste en ablación circunferencial punto a punto de los dos antros (izquierdo y derecho) de las VP, utilizando catéter de punta irrigada (en 12 casos con catéter FlexAbility, sistema Ensite Navx, y en cuatro con catéter SmartTouch, sistema Carto3). Se confirmó aislamiento eléctrico bidireccional en las 64 VP con catéter circunferencial de 20 polos. Todos los pacientes permanecieron una noche hospitalizados. No hubo complicaciones agudas asociadas al procedimiento de ablación. Se hizo un seguimiento postablación con Holter ECG y valoración clínica durante el año posterior al procedimiento. También se realizó CRM con secuencia 4D Flow entre los 3-12 meses tras la ablación, ya que la estenosis de VP tras radiofrecuencia suele ocurrir gradualmente a partir de los tres meses del procedimiento y suceder en la vena distal, próxima al ostium7.
La CRM, tanto la previa como la posterior a la ablación, se realizó en una unidad de RM 1.5T GE Optima MR450w (GE Healthcare, Milwaukee, WI, EE.UU.) con una antena de 32 canales y con sincronización cardiaca. La CRM incluyó secuencias cine eco de gradiente, steady state free precesion (SSFP), habituales para estudio de la anatomía y función cardiacas. La secuencia 4D Flow se adquiere durante la infusión de contraste intravenoso 0.15 mmol/kg (Gadovist 1 mmol/ml; Bayer, Mijdrecht, Países Bajos) y en respiración libre con compensación respiratoria y gating retrospectivo sobre electrocardiograma para reconstruir en 30 fases del ciclo cardiaco. La adquisición dura entre 7 y 10 minutos, adaptándose automáticamente al ritmo cardiaco de cada paciente. Tiene una resolución adquirida de 2,78 × 2,78 × 2,40 mm3 (RL × Ap × IS) y una resolución reconstruida de 1,95 × 9,95 × 1,20 mm3 (ZIP × 2). Para la adquisición de la secuencia 4D Flow en este estudio se codificó con una velocidad (velocity encoding sensitivy [VENC]) de 100 cm/s específica para el estudio de vasos de bajo flujo y baja velocidad como son las VP. Completamos el estudio con secuencias tras contraste, inmediatamente tras la secuencia 4D Flow, entre 7-10 minutos tras la inyección, 3D FSPGR ponderada en T1 con contraste intravenoso en apnea en plano axial al tórax para valoración anatómica de las VP (adquisición muy rápida, inferior a 40 s).
Para el análisis de CRM, en primer lugar, estudiamos la anatomía cardiaca y de las VP para descartar variantes anatómicas. Posteriormente realizamos medidas morfológicas del diámetro (eje transversal mayor) de las VP sobre las secuencias 3D FSPGR. Recogimos los datos funcionales en CRM previa a la ablación para conocer la situación basal del paciente.
Sobre las secuencias 4D Flow realizamos las mediciones de diámetro morfológico y las variables de flujo, trabajando el software en nube Arterys (Arterys Inc., San Francisco, CA, EE.UU.) que, por medio de un posproceso semiautomático, nos aporta una imagen morfológica con la información de flujo codificada en color dependiendo de la velocidad. Proporciona datos cuantitativos, reproducibles y clínicamente relevantes, y se ha probado y validado en imágenes de RM adquiridas mediante escáneres de RM de 1,5 y 3,0 T.
Se dibuja una region of interest (ROI) en un plano perpendicular doble oblicuo al vaso que se pretende estudiar, con lo que obtenemos el diámetro y valores cuantitativos y cualitativos de flujo (Fig. 1).
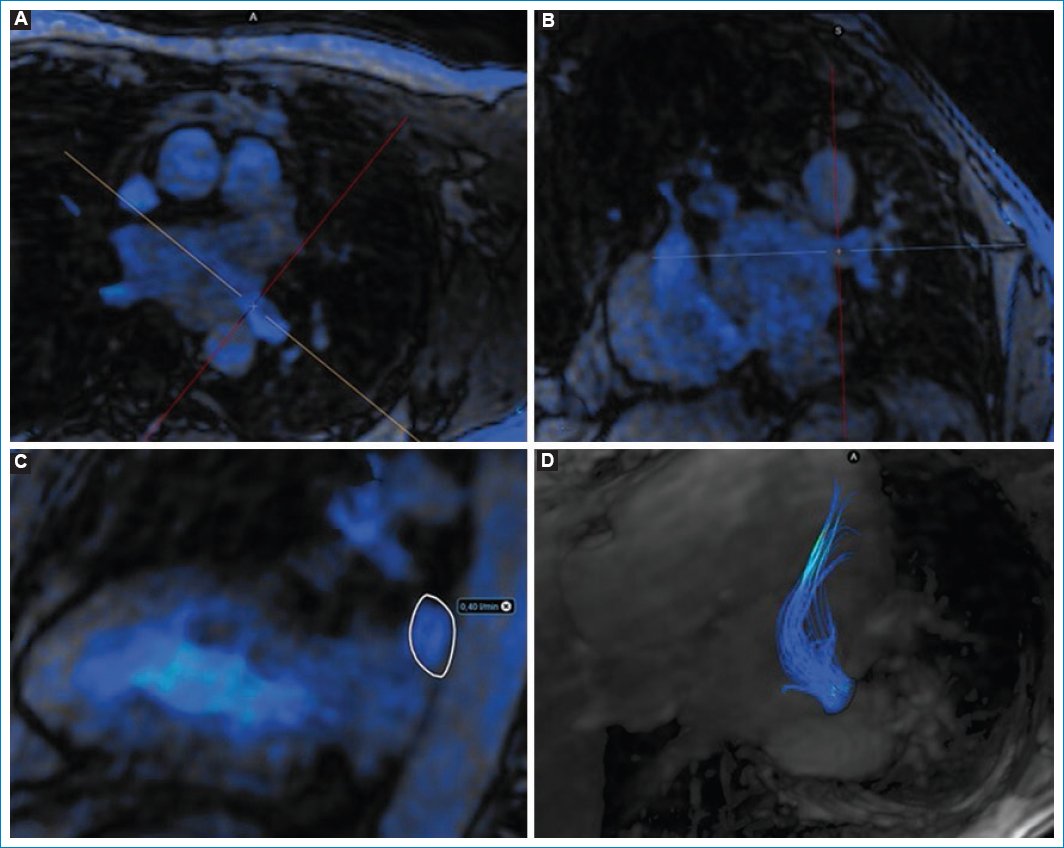
Figura 1. Imagen de la secuencia 4D Flow sobre VPII. (A y B) Imagen en axial y coronal oblicua para localizar el plano doble ortogonal a la VPII. (C) ROI dibujado sobre el plano perpendicular a la vena de estudio. En A, B y C se puede observar la morfología y diámetro de la vena a estudio, sin identificar estenosis morfológicas significativas. (D) Reconstrucción con MIP y representación del flujo de entrada en cavidades izquierdas de la VPII.
Para llevar a cabo el análisis tanto de morfología como de flujo, realizamos mediciones a 1-1,5 cm del ostium para evitar flujo paradójico de la aurícula de cada una de ellas, siempre en este orden: vena pulmonar superior derecha (VPSD), vena pulmonar inferior derecha (VPID), vena pulmonar superior izquierda (VPSI) y vena pulmonar inferior izquierda (VPII).
Tanto en la CRM preablación como postablación recogemos las variables de cada VP: diámetro transversal mayor (en mm) medido en secuencia anatómica y sobre secuencia 4D Flow y los parámetros de flujo: velocidad (en cm/min) y flujo (en l/min) de la secuencia 4D Flow.
El análisis de la CRM preablación se realizó de forma independiente por dos lectores, dos radiólogos, uno con más de 10 años de experiencia en CRM (AA) y otro con más de 10 años de experiencia en imagen (técnico de rayos en activo durante 10 años) y en proceso de formación (residente de radiología de segundo año) en CRM (JT). El análisis de CRM postablación se realizó por AA de similar manera, sin comparar con los datos obtenidos en el estudio inicial. El lector JT, un mes después de las primeras medidas para evitar sesgo de recuerdo, repitió las mediciones de la CRM preablación, sin acceso a los datos de la primera medición para analizar la variabilidad intraobservador.
Análisis estadístico
Para el análisis descriptivo, se emplearon frecuencias absolutas (n) y relativas para resumir las variables cuantitativas, y se calculó la media y la desviación estándar (DE) o la mediana y el intervalo intercuartil (Q1, Q3) para resumir las variables cuantitativas, de acuerdo con si presentaban o no una distribución normal, evaluada mediante pruebas de Shaphiro-Wilk. Se evaluaron los cambios en el diámetro, velocidad y flujo en cada una de las localizaciones anatómicas entre las CRM realizadas pre- y postablación, empleando para ello pruebas de t de Student para datos pareados o pruebas de Wilcoxon en función del comportamiento de la variable. Para evaluar el grado de acuerdo absoluto (concordancia interobservador e intraobservador) en la medición del diámetro, velocidad y flujo venoso en cada una de las localizaciones anatómicas, se calculó el coeficiente de correlación intraclase (CCI) y el intervalo de confianza al 95% (IC 95%).
Se empleó el análisis de Bland-Altman para evaluar la concordancia entre las mediciones del diámetro de la VP obtenidas utilizando dos instrumentos, 4D Flow y morfológico. Este análisis cuantifica la concordancia por medio de la diferencia de medias y los límites de acuerdo, proporcionando una evaluación visual del sesgo y un intervalo de acuerdo del 95% entre métodos.
Los análisis se realizaron con las herramientas estadísticas del programa Stata BE/17.0 (Statacorp LLC) y se estableció un nivel de significación del 5% (p < 0,05).
Según el IC 95% de la estimación del CCI, los valores inferiores a 0,5, entre 0,5 y 0,75, entre 0,75 y 0,9 y superiores a 0,90 son indicativos de una confiabilidad deficiente, moderada, buena y excelente, respectivamente 23.
Resultados
Características de la muestra
En total se incluyeron 16 pacientes, con CRM previa y 14 con CRM postratamiento, ya que dos pacientes se negaron a realizarse la RM de control por motivos no médicos. Ninguno presentó complicación aguda ni a corto plazo tras el procedimiento.
Se estudió a un total de 16 pacientes, 14 hombres y 2 mujeres, con una edad (media ± DE) de 62,6 ± 10,24 años, sin cardiopatía estructural con historia de FA persistente y resistente al tratamiento médico. En la table 1 se describen las características basales de la muestra.
Tabla 1. Características de la muestra
| Pacientes | Edad (años) | Sexo | Peso (kg) | IMC | FEVI (%) |
|---|---|---|---|---|---|
| 1 | 68 | H | 88 | 31,93 | 35 |
| 2 | 70 | H | 83 | 32,42 | 55 |
| 3 | 72 | H | 57 | 21,72 | 61 |
| 4 | 66 | H | 74 | 25,91 | 61 |
| 5 | 47 | H | 80 | 23,89 | 47 |
| 6 | 44 | H | 66 | 20,60 | 57 |
| 7 | 62 | H | 85 | 32,39 | 48 |
| 8 | 61 | H | 88 | 30,09 | 70 |
| 9 | 72 | M | 53 | 21,50 | 52 |
| 10 | 63 | H | 70 | 23,94 | 54 |
| 11 | 67 | M | 64 | 23,23 | 56 |
| 12 | 43 | H | 68 | 21,46 | 58 |
| 13 | 77 | H | 72 | 26,45 | 51 |
| 14 | 71 | H | 65 | 24,46 | 39 |
| 15 | 59 | H | 73 | 26,81 | 60 |
| 16 | 59 | H | 79 | 25,22 | 47 |
|
FEVI: fracción de eyección del ventrículo izquierdo; H: hombre; IMC: índice de masa corporal; M: mujer. |
|||||
En las secuencias anatómicas se confirmó la presencia de cuatro VP en cada paciente (ningún caso mostró tronco común izquierdo ni VP accesorias), realizando el estudio sobre 64 VP. No se detectaron trombos intraauriculares.
En la table 2 se describen los parámetros funcionales obtenidos en la CRM previa a la ablación.
Tabla 2. Valores funcionales obtenidos en la cardiorresonancia magnética previa a la ablación
| Frecuencia cardiaca (latidos/min) | 65 ± 18,9 |
|---|---|
| VTD VI (ml) |
164,6 ± 36,8 |
| VTS VI (ml) |
85,2 ± 20,5 |
| FEVI (%) |
52,6 ± 10,3 |
| Gasto cardiaco (l/min) |
5,9 (4-7,1) |
| Área de AI (cm2) |
30,1 ± 7,5 |
|
* Media ± desviación estándar. † Mediana (rango intercuartílico). AI: aurícula izquierda; FEVI: fracción de eyección del ventrículo izquierdo; VTD VI: volumen telediastólico del ventrículo izquierdo; VTS VI: volumen telesistólico del ventrículo izquierdo. |
|
Concordancia entre el diámetro morfológico y en la secuencia 4D Flow
Obtuvimos una excelente concordancia (CCI > 0,90) en las medidas de diámetro de las cuatro VP al comparar la medición en secuencias morfológicas con la medición sobre la secuencia de 4D Flow (Fig. 2).
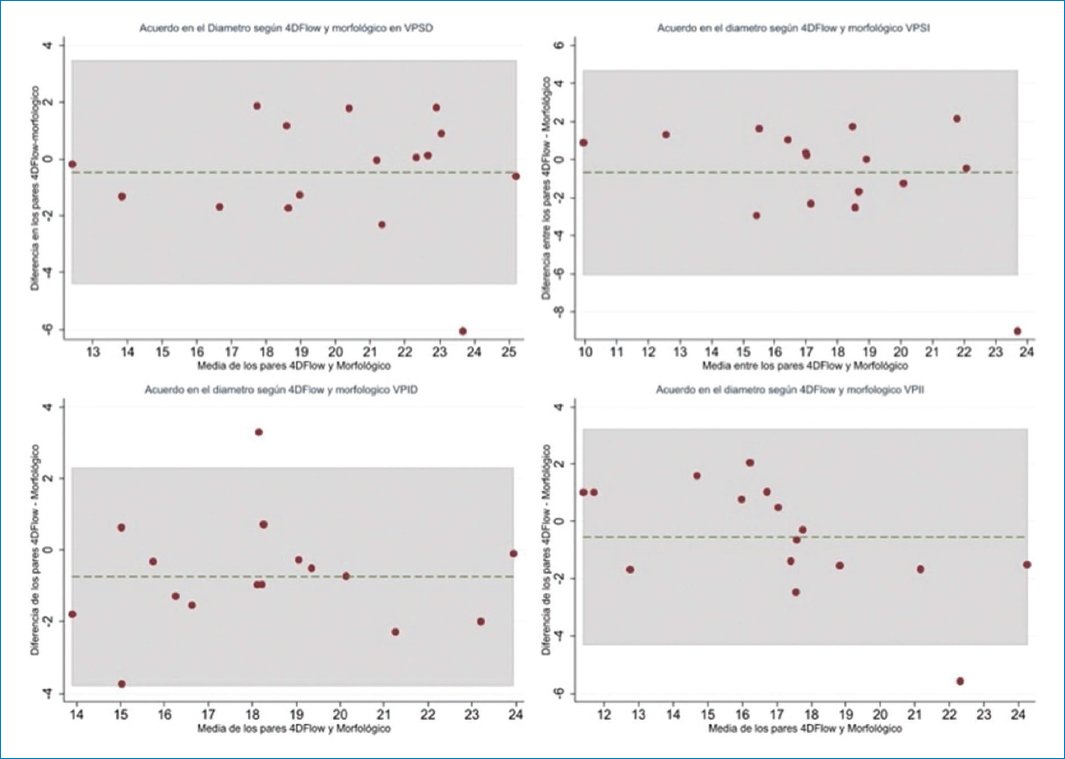
Figura 2. Análisis Bland-Altman comparando las medidas de diámetro.
Concordancia intraobservador en las medidas de la secuencia 4D Flow de diámetro, flujo y velocidad en cada VP
Obtuvimos excelente concordancia intraobservador (CCI > 0,90) en las medidas de diámetro y flujo de las VP (VPSD; VPID, VPSI y VPII) en la secuencia 4D Flow. En cuanto a la velocidad del flujo de las cuatro VP, la concordancia intraobservador es también excelente (CCI > 0,80) (Table 3).
Tabla 3. Correlación intraobservador de las medidas de flujo, diámetro y velocidad en la secuencia de 4D Flow
| Variable | CCI (IC 95%) |
|---|---|
| Diámetro | |
| VPSD | 0,97 (0,91-0,99) |
| VPID | 0,96 (0,88-0,98) |
| VPSI | 0,96 (0,88-0,98) |
| VPII | 0,94 (0,83-0,98) |
| Flujo | |
| VPSD | 0,99 (0,97-1,00) |
| VPID | 0,97 (0,91-0,99) |
| VPSI | 0,96 (0,86-0,99) |
| VPII | 0,99 (0,98-1,00) |
| Velocidad | |
| VPSD | 0,87 (0,35-0,96) |
| VPID | 0,86 (0,43-0,93) |
| VPSI | 0,81 (0,43-0,93) |
| VPII | 0,86 (0,59-0,95) |
|
CCI: coeficiente de correlación intraclase; IC: intervalo de confianza; VPID: vena pulmonar inferior derecha; VPII: vena pulmonar inferior izquierda; VPSD: vena pulmonar superior derecha; VPSI: vena pulmonar superior izquierda. |
|
Concordancia interobservador en las medidas de la secuencia 4D Flow de diámetro, flujo y velocidad en cada VP
Se ha obtenido buena concordancia (CCI > 0,70) al comparar las variables diámetro y flujo entre dos operadores independientes, siendo especialmente alta entre los observadores en la medición de flujo.
La correlación interobservador de la medida de velocidad de las VP en la secuencia 4D Flow fue aceptable (CCI: 0,48-0,73) (Table 4).
Tabla 4. Correlación interobservador de las medidas de flujo, diámetro y velocidad en la secuencia de 4D Flow
| Variable | CCI (IC 95%) |
|---|---|
| Diámetro | |
| VPSD | 0,94 (0,84-0,98) |
| VPID | 0,76 (0,33-0,91) |
| VPSI | 0,84 (0,53-0,94) |
| VPII | 0,80 (0,43-0,93) |
| Flujo | |
| VPSD | 0,96 (0,87-0,99) |
| VPID | 0,94 (0,84-0,98) |
| VPSI | 0,92 (0,79-0,97) |
| VPII | 0,83 (0,52-0,94) |
| Velocidad | |
| VPSD | 0,73 (0,25-0,91) |
| VPID | 0,48 (0,39-0,81) |
| VPSI | 0,54 (0,21-0,83) |
| VPII | 0,51 (0,19-0,82) |
|
CCI: coeficiente de correlación intraclase; IC: intervalo de confianza; VPID: vena pulmonar inferior derecha; VPII: vena pulmonar inferior izquierda; VPSD: vena pulmonar superior derecha; VPSI: vena pulmonar superior izquierda. |
|
Medidas en CRM pre- y postablación
Se obtuvo una diferencia en las medidas de diámetro de las VP medido en la secuencia 4D Flow antes y después de la ablación con una reducción del diámetro significativa en VPSI (p = 0,02) y VPII (p = 0,01). En VPSD y VPID se alcanzó un valor no significativo (p = 0,08 y p = 0,10, respectivamente) (Fig. 3).
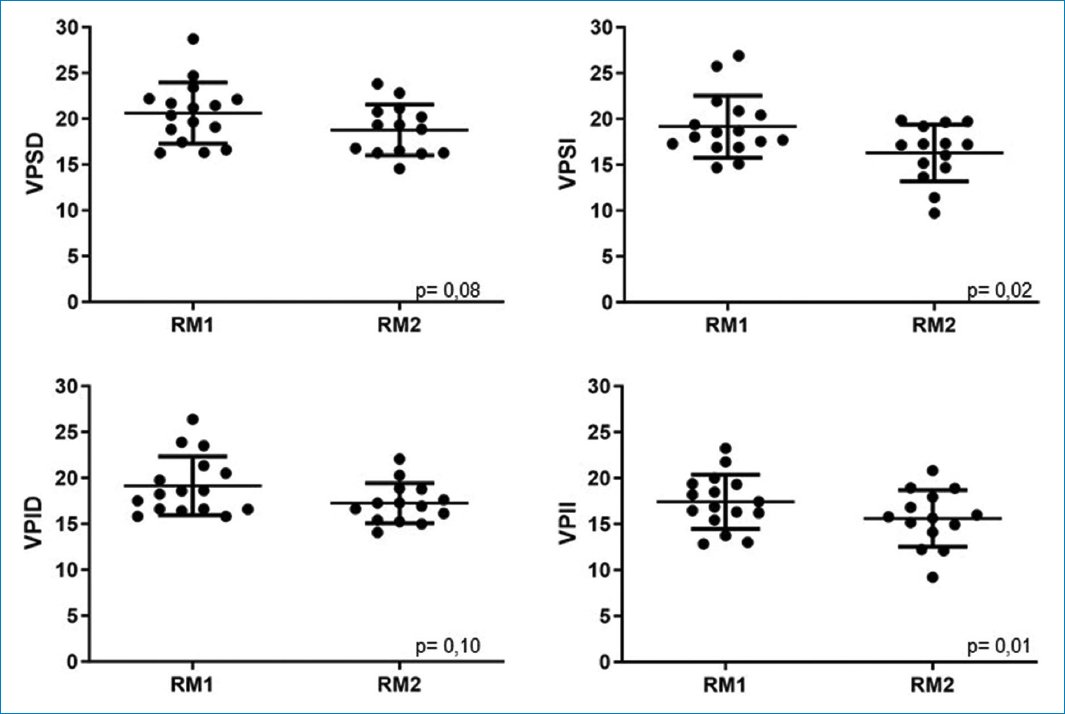
Figura 3. Comparativa en el tiempo de la medida de diámetro (mm) entre la cardiorresonancia magnética antes y después de la ablación.
Se observó una reducción de calibre de las VP mayor del 10% en 21 de 56 VP (37,5%), con una reducción media del 21% y una máxima del 44% (en una VPSI), lo que supondría, en todos los casos, una estenosis leve, según la clasificación de la Sociedad Europea de arritmias cardiacas (2012), definiendo estenosis con base en la reducción del diámetro: leve (< 50%), moderada (50-70%) y grave (> 70%)6,7.
En el seguimiento de estos pacientes no se han identificado síntomas secundarios a estenosis de VP.
No obtuvimos diferencias significativas entre las medidas de velocidad y de flujo en la secuencia 4D Flow previa y posterior a la ablación de las VP.
Discusión
Nuestros resultados mostraron que la secuencia 4D Flow nos aporta información sobre el diámetro de las VP comparable a los diámetros obtenidos de las secuencias ponderadas en T1 con contraste intravenoso. Además, esta secuencia añade información sobre el flujo y la velocidad del flujo de las VP que, según nuestra valoración inicial, es una información reproducible y comparable en el tiempo.
En primer lugar, hemos encontrado una concordancia excelente entre el diámetro de VP medido en secuencias morfológicas y el diámetro medido en la secuencia 4D Flow. Esto permite que podamos valorar la existencia de una posible estenosis morfológica en cualquier VP con la secuencia 4D Flow, sin necesidad de añadir, en teoría, otras secuencias morfológicas al estudio. Con una única secuencia, en respiración libre, tenemos la información morfológica de las VP y eventuales variantes anatómicas.
En segundo lugar, hemos obtenido excelente concordancia intraobservador e interobservador en lo referente a las medidas del diámetro y flujo, lo que nos indica solidez y reproducibilidad en estas medidas.
La concordancia interobservador del parámetro velocidad de flujo nos indica que es una medida menos reproducible. Una posible justificación de esta discrepancia es que la velocidad del flujo en las venas pulmonares varía por pequeños giros o elongaciones, siendo altamente dependiente de la localización dentro de la vena; incluso una separación de pocos milímetros puede generar cambios en la medición. No obstante, en ningún caso hemos registrado velocidades que superen los 130 cm/s, que según algunos autores indicaría que no existe estenosis clínicamente significativa24, concordante con los hallazgos morfológicos de nuestro estudio, donde no existen estenosis moderadas ni graves.
En cuanto a la comparación en el tiempo, previo y posterior a la ablación, de las medidas de diámetro de las VP medido en la secuencia 4D Flow existe una pequeña disminución de calibre de las VP, correspondiendo en todos los casos a estenosis leves. Los datos de estenosis que hemos obtenido concuerdan con lo visto en otras series, que indicaban una reducción del diámetro en hasta un 24-31% de los casos, siempre que fuese leve6,25–27.
De hecho, se relaciona, por un lado, el tamaño basal de las VP con el riesgo de recurrencia28,29 y, por otro, la disminución de diámetro de las venas con la formación de escara de fibrosis, siendo la ausencia de esta también un indicador de recurrencia, por lo que esta disminución de tamaño podría estar en relación con el éxito del procedimiento26,30.
Consideramos consecuente que, al no existir estenosis morfológicas moderadas ni graves en nuestro estudio, no exista variación significativa en la comparativa de flujo o velocidad de VP entre el estudio antes y después de la ablación, ya que no existe repercusión hemodinámica que afecte a los parámetros de flujo.
El estudio de CRM con 4D Flow, con información anatómica y de flujo de las VP, similar a la información Doppler (donde se puede estudiar el flujo y la velocidad de flujo en VP24,31), nos sirve, de esta forma, para evaluar la repercusión en el flujo de una reducción de diámetro morfológico de las VP, evitando así angiografías innecesarias, ya que se ha visto que puede existir algún caso de discrepancia entre la información anatómica con la angiografía de VP, que se considera el método de referencia7.
Como hemos mencionado anteriormente, la secuencia 4D Flow ha sido ampliamente validada para el estudio de flujos y estructuras vasculares desde la década de 2010, aunque su uso clínico está aún en evolución, sobre todo por los problemas iniciales de gating respiratorio y elevado tiempo de adquisición.
En los últimos años, además, han comenzado a estudiarse aplicaciones distintas a las más estudiadas (valvulopatías o cardiopatía congénita), como la valoración de flujos venosos o flujo intracardiaco, con nuevos parámetros hemodinámicos como la energía cinética, turbulencia, viscosidad, tensión de corte vascular, entre otros.
Artículos publicados han expuesto la utilidad de parámetros funcionales en VP para predecir trombosis venosa tras lobectomía o predecir alteraciones eléctricas que conlleven riesgo de FA21,22.
No tenemos conocimiento de que haya sido estudiado el uso de la secuencia 4D Flow en las VP en el contexto de ablación hasta la fecha. Nuestros resultados sugieren que la secuencia 4D Flow aporta parámetros de éxito de ablación de VP y diagnóstico de complicaciones, de forma reproducible y comparable.
Aunque la estenosis de VP es una complicación poco frecuente, es potencialmente grave y puede pasar desapercibida sin una prueba de imagen. Se deben evaluar posibles complicaciones, sobre todo ante clínica inexplicable o poco predecible. Además, una reducción del diámetro de las venas puede considerarse prueba del éxito del procedimiento.
Dado que la desventaja fundamentalmente es que aumenta el tiempo de adquisición, ya que la secuencia 4D Flow presenta un tiempo de adquisición mayor que las secuencias anatómicas, se podría considerar añadir al estudio de CRM dicha secuencia en casos seleccionados donde haya sospecha de complicación, ya sea clínica o de imagen. De esta manera, en estos casos seleccionados, se podría considerar como la prueba de seguimiento en la práctica clínica.
También creemos que se puede implementar el uso de la secuencia 4D Flow para estudio de VP en otras afecciones, para determinar el flujo que aporta cada vaso en casos de variantes anatómicas o cortocircuitos cardiacos, valorar el flujo y anatomía venosa en otras planificaciones quirúrgicas o ante la sospecha de complicaciones posquirúrgicas.
Limitaciones
Las limitaciones propias de la secuencia 4D Flow son, como ya hemos mencionado, el tiempo de adquisición, que alarga ligeramente el estudio cardiaco, y la peor calidad diagnóstica en casos en los que esté contraindicado el contraste intravenoso.
Una limitación de nuestro estudio es que se trata de una serie corta de pacientes para una valoración inicial de la secuencia 4D Flow en el estudio de VP, donde hemos encontrado buena concordancia, y, sobre todo, consistencia de las medidas del mismo paciente, en diferentes tiempos. Esto anima a estudiar más casos con sospecha de estenosis grave y así poder comparar con angiografía de VP que, siendo un procedimiento invasivo, está reservado para casos de complicaciones sintomáticas.
Son necesarios estudios prospectivos y con casos de estenosis graves de VP, para evaluar su capacidad diagnóstica y, sobre todo, pronóstica, valorando la velocidad máxima alcanzada en el punto de mayor reducción de calibre.
Conclusiones
La CRM con secuencia 4D Flow nos permite valorar el diámetro morfológico de las VP, comparable con las secuencias anatómicas, a la vez que aporta información de flujo y velocidad de flujo de las VP. Esto nos permite una valoración anatómica y funcional con una sola secuencia de una prueba de imagen no invasiva, capaz de diagnosticar cambios en el calibre de las VP tras procedimiento y su repercusión hemodinámica, por tanto, útil en la sospecha clínica de estenosis de VP.
Financiamiento
Los autores declaran no haber recibido financiamiento para este estudio.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki. Los procedimientos fueron autorizados por el Comité de Ética de la institución.
Confidencialidad, consentimiento informado y aprobación ética. Los autores han seguido los protocolos de confidencialidad de su institución, han obtenido el consentimiento informado de los pacientes, y cuentan con la aprobación del Comité de Ética. Se han seguido las recomendaciones de las guías SAGER, según la naturaleza del estudio.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.