Historia clínica
Mujer de 20 años, transferida desde un centro externo después de presentarse en el departamento de emergencias con quejas de cuatro episodios de entumecimiento y hormigueo en todo el lado derecho de la cara y el cuerpo desde la semana anterior. Afirma que durante las últimas dos-tres semanas también ha estado experimentando dolores de cabeza, vértigo, náuseas y visión borrosa. Niega emesis y cualquier historial médico o quirúrgico previo.
Dio a luz a un niño seis semanas antes sin ninguna complicación. La revisión de los sistemas es positiva para náuseas, visión borrosa, dolores de cabeza, vértigo, entumecimiento y hormigueo.
Examen
Disminución de la sensibilidad en la cara y las extremidades derechas.
Resonancia magnética
Las imágenes de resonancia magnética (RM) muestran una masa frontoinsular izquierda, hipointensa en la secuencia ponderada en T1 (Fig. 1), hiperintensa en T2 (Fig. 2) e hiperintensa en FLAIR (Fig. 3), pero con centro de menor intensidad. Este hallazgo, llamado “signo de la discrepancia”, es propio de las neoplasias gliales con IDH (isocitrate dehidrogenase) mutado y sin codeleción en 1p/19q1,2, y se observa en los astrocitomas. La codeleción 1p/19q es propia de los oligodendrogliomas3,4. La volumetría indica un volumen de 84 cm3 (Fig. 4).
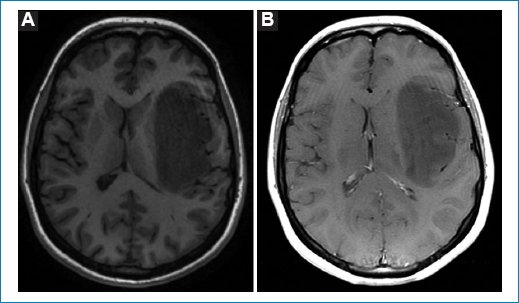
Figura 1. Secuencia ponderada en T1. (A) Masa hipointensa en la región frontoinsular izquierda. (B) No se visualiza realce focal después de administrar contraste paramagnético.
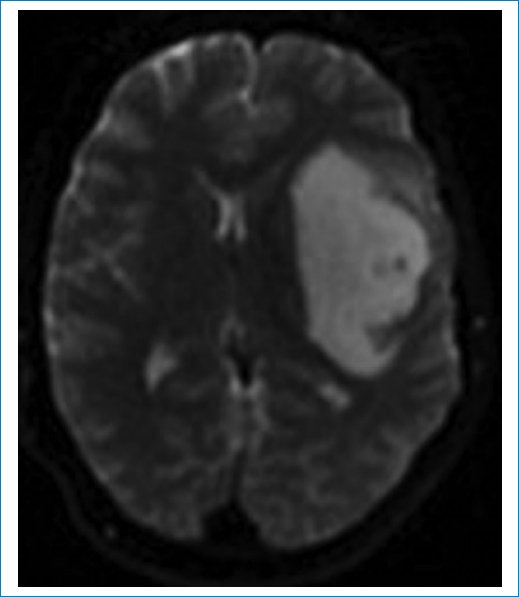
Figura 2. Secuencia ponderada en T2. Masa hiperintensa.
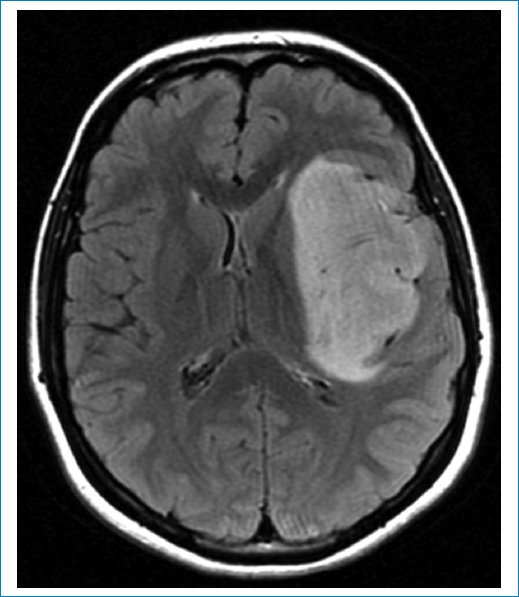
Figura 3. Secuencia FLAIR. Hiperintensidad mayor en la periferia (“signo de la discrepancia”), típica de los gliomas, IDHm sin codeleción 1p/19q.
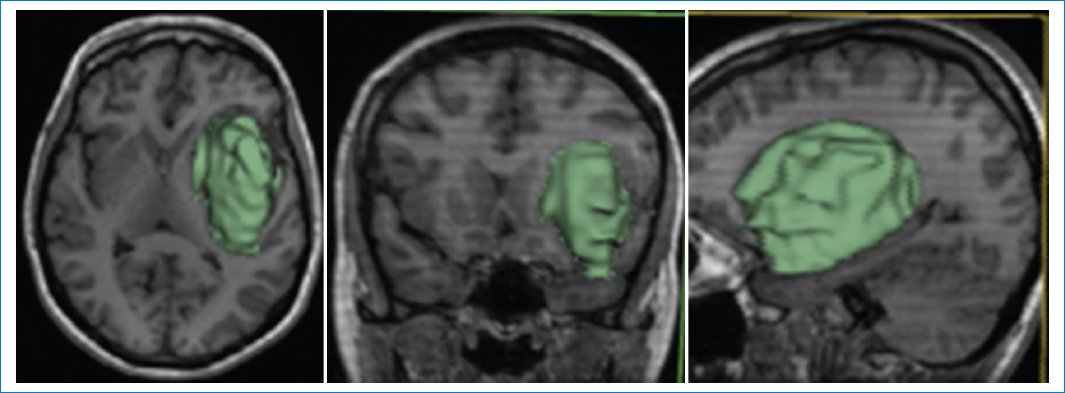
Figura 4. Volumetría: 84,06 cm3.
La secuencia de difusión aporta un ADC diferente en la periferia de la neoplasia (0,69 × 10–3 mm2/s) (Fig. 5), que es bajo, indicando mayor celularidad, y es alto en el centro (1,75 × 10–3 mm2/s)5,6. Este último valor refuerza la hipótesis de un IDHm y no codeleción de 1p/19q. Lo mismo ocurre con los valores obtenidos en la medición de la anisotropía fraccional, la difusión paralela y la difusión perpendicular7–9 (Fig. 6).
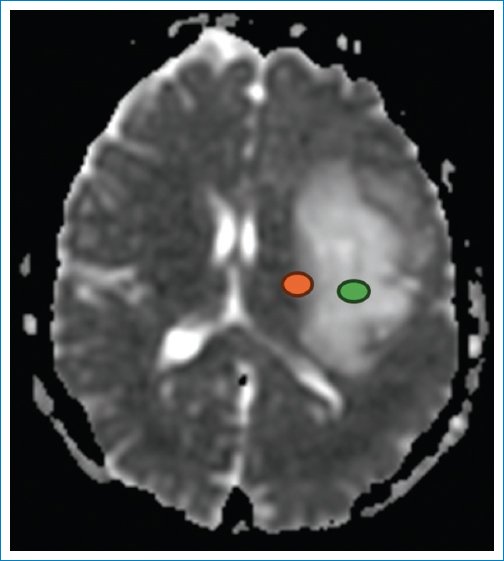
Figura 5. ADC = 0,69 × 10–3 mm2/s (en naranja) y 1,75 × 10–3 mm2/s (en verde).
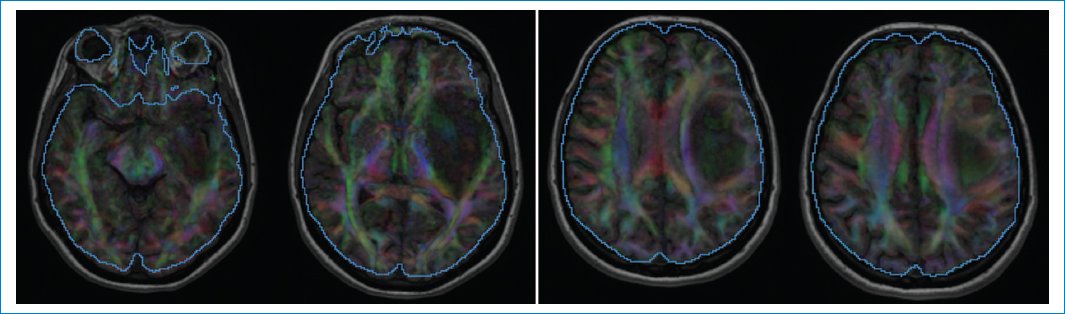
Figura 6. Tensores de difusión. FA = 0,075 (n = 0,21). Difusividad paralela = 1,45 (n = 1,21). Difusividad perpendicular = 1,29 (n = 0,91).
Es de particular interés la incorporación de los valores del índice DTI-ALPS (diffusion tensor imaging along the perivascular space)10, que indica la integridad del sistema glinfático. Este sistema se inicia desde el espacio subaracnoideo, donde el líquido cefalorraquídeo (LCR) ingresa por convección hacia el parénquima cerebral a lo largo de los espacios perivasculares de Virchow Robin, caracterizados por una matriz fibrosa laxa que confiere baja resistencia al paso del LCR. Este fluye a través de la membrana basal glial y los procesos astrogliales que expresan una alta concentración de canales de acuaporina 4, cuya organización molecular disminuye la resistencia y facilita el flujo del LCR desde el compartimento perivascular hacia el parénquima cerebral. Una vez en el intersticio, se mezcla con el líquido intersticial cerebral y el fluido se dispersa de acuerdo con la presión osmótica e hidrostática de los dos compartimentos, con un movimiento neto hacia el espacio perivenoso y de allí a los ganglios linfáticos. El índice ALPS refleja la difusividad a lo largo de los espacios perivasculares de las venas medulares, que constituyen una parte importante del sistema glinfático. Por lo tanto, una disminución del índice ALPS podría indicar, en parte, un deterioro del sistema glinfático en pacientes con glioma, como se observó en experimentos con roedores, en los que el glioma pudo inducir una reducción del flujo de salida de LCR. Cabe destacar que el índice ALPS en el hemisferio contralateral de los pacientes también disminuye significativamente en comparación con el de los controles sanos. Estos hallazgos indican que el glioma podría inducir disfunción glinfática en el hemisferio contralateral, siendo el edema vasogénico global inducido por el glioma la causa principal (Fig. 7).
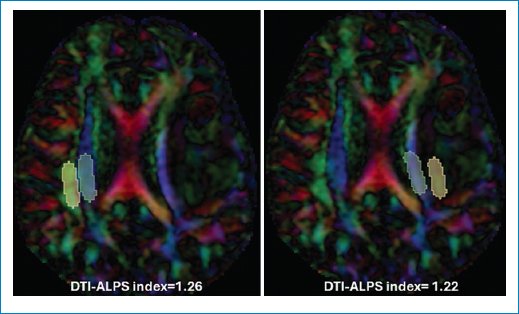
Figura 7. Sistema glinfático. Valor normal para edad 20-40 años = 1,50 a 1,65.
Los síntomas de la paciente pueden ser correlacionados con su lesión extendida al área central izquierda, lo cual es muy bien graficado en el estudio de RM en estado de reposo11,12 (Fig. 8).
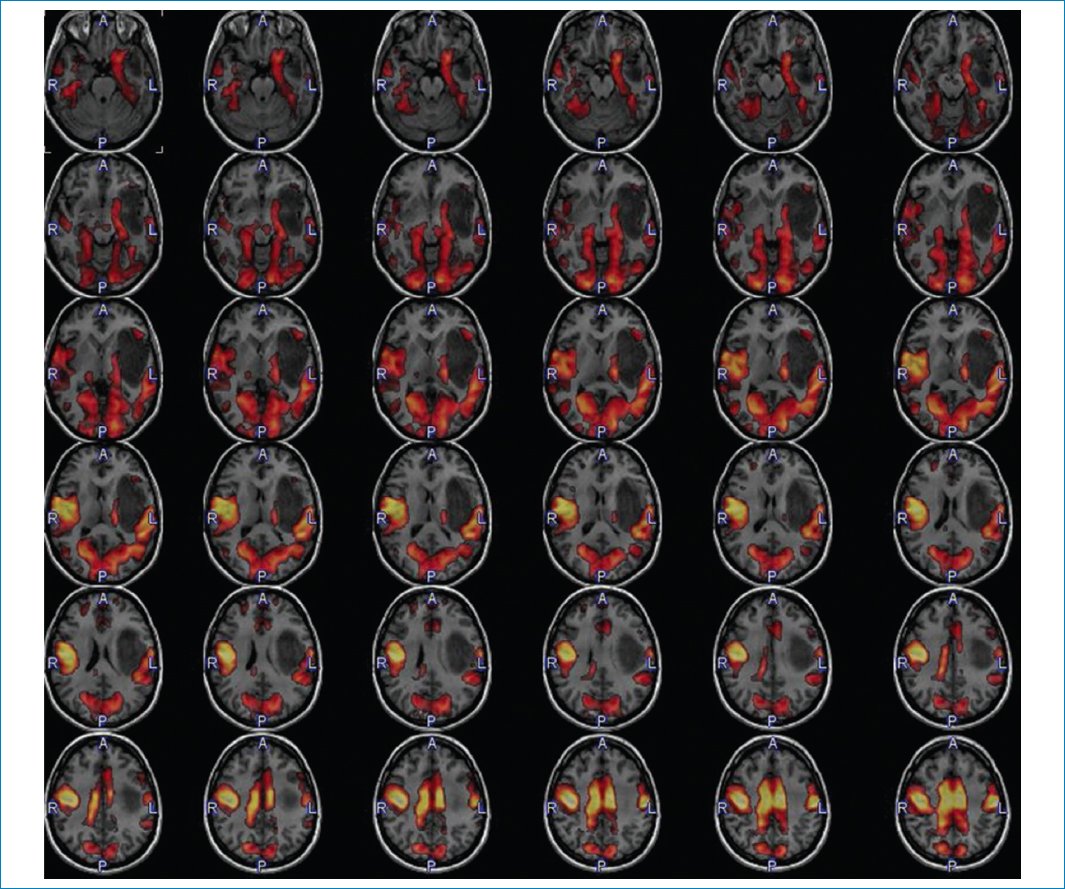
Figura 8. Relación de la masa con las proyecciones sensitivomotoras. RM funcional en estado de reposo.
Obsérvese la correlación de los hallazgos en la RM con el resultado de la histopatología y, especialmente, la evaluación molecular. También en este caso la RM ha podido determinar la mutación IDH y la no codeleción 1p/19q (Figs. 9–15).
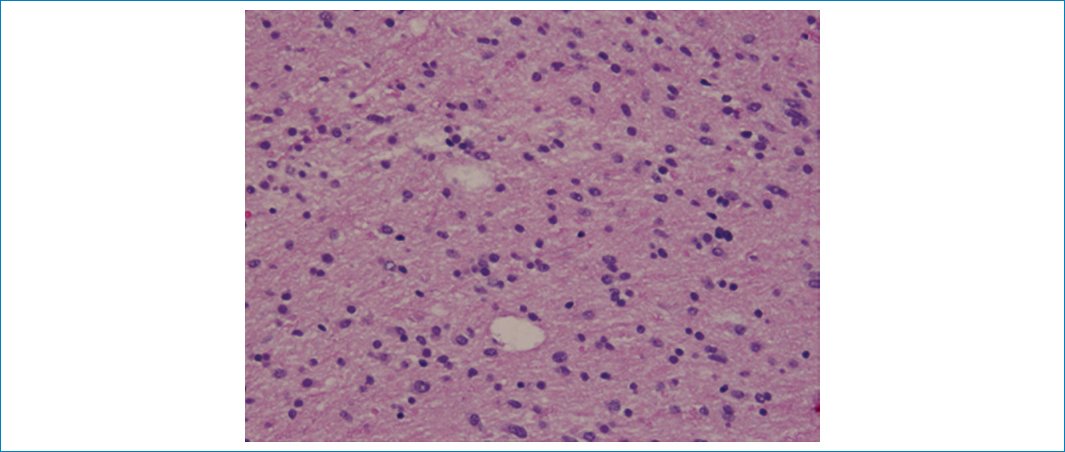
Figura 9. La imagen de aumento medio de las secciones teñidas con hematoxilina y eosina muestra un aumento moderado de la celularidad debido a la presencia de una neoplasia glial infiltrante difusa con núcleos ovalados a redondos ligeramente agrandados. No se observan figuras mitóticas, proliferación microvascular ni necrosis.
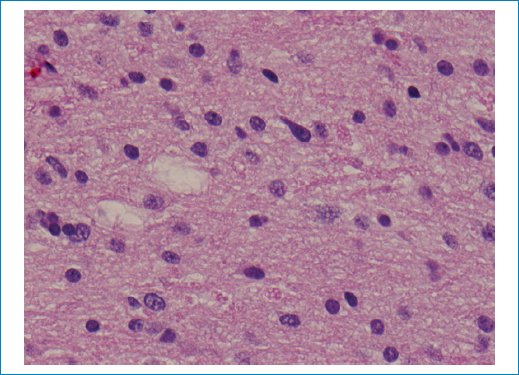
Figura 10. Una vista de mayor aumento de las secciones teñidas con hematoxilina y eosina muestra que las células gliales atípicas tienen nucleolos de discretos a pequeños. No se observa ningún aclaramiento del citoplasma perinuclear (aspecto de “huevo frito”).
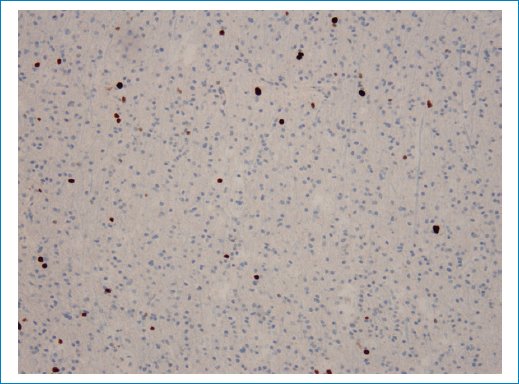
Figura 11. Se visualiza un leve aumento de la fracción proliferativa, como se observa con la inmunotinción KI67.
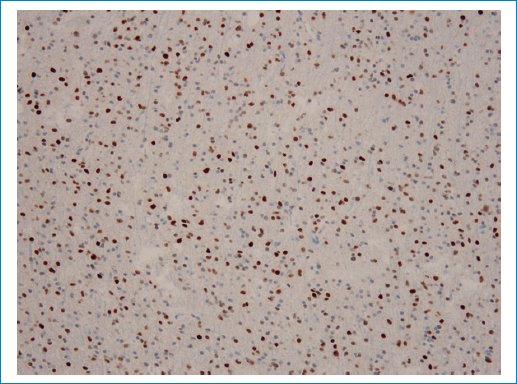
Figura 12. Se observa un aumento significativo en la tinción nuclear de células neoplásicas para p53.
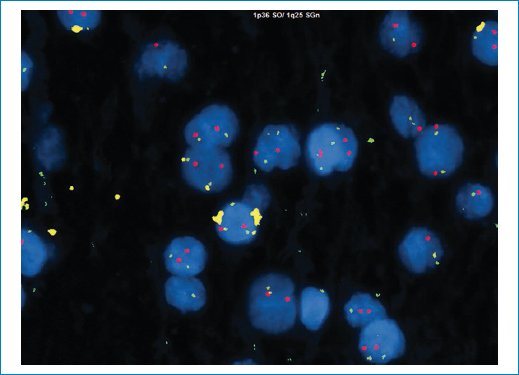
Figura 13. La hibridación fluorescente in situ es negativa para la pérdida concurrente de 1p/19q, que sería típica de una neoplasia oligodendroglial.
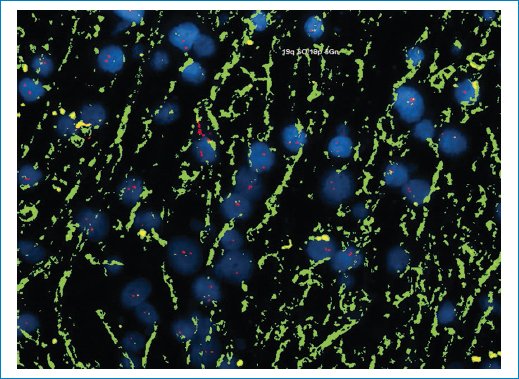
Figura 14. La hibridación fluorescente in situ es negativa para las alteraciones del número de copias del cromosoma 19.
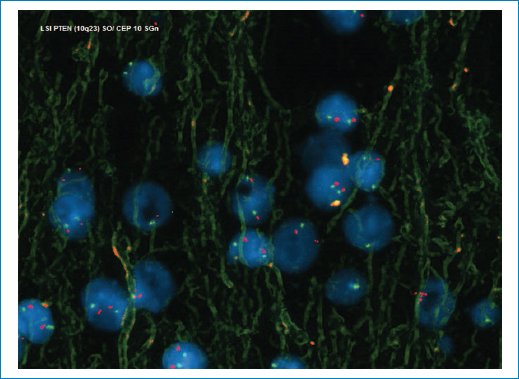
Figura 15. La hibridación fluorescente in situ es negativa para las alteraciones del número de copias del cromosoma 10 y pérdida de PTEN.
Imágenes de patología
DIAGNÓSTICO HISTOPATOLÓGICO
- – Oligoastrocitoma, grado II de la Organización Mundial de la Salud (fuera de III).
- – No se identifica LOH 1p y 19q.
- – No hay pérdida de PTEN.
COMENTARIO SOBRE LA PATOLOGÍA
En el esquema actual de la Organización Mundial de la Salud, el oligoastrocitoma ya no se usa. Esta lesión muestra las características histológicas de un glioma de grado 2.
Conclusión
Se ha seleccionado un caso que asocia secuencias comunes y avanzadas de RM y el resultado histopatológico, incluyendo técnicas de histopatología molecular. Los resultados de estas técnicas, según la Organización Mundial de la Salud, deberían estar agregados al informe imagenológico.
Financiamiento
Los autores declaran no haber recibido financiamiento para este estudio.
Conflicto de intereses
E. González-Toledo declara ser editor en jefe de la Revista Argentina de Radiología. J. Wilson declara no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética.
Los autores han seguido los protocolos de confidencialidad de su institución, han obtenido el consentimiento informado de la paciente, y cuentan con la aprobación del Comité de Ética. Se han seguido las recomendaciones de las guías SAGER, según la naturaleza del estudio.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.