Introducción
El síndrome epiléptico relacionado con infección febril (FIRES) es una subcategoría del estado epiléptico refractario de inicio reciente, que requiere una infección febril previa, con fiebre que comienza entre dos semanas y 24 horas antes del inicio del estado epiléptico refractario con o sin episodios febriles al inicio de las convulsiones1. Existen hipótesis basadas en un mecanismo que envuelve una reacción cruzada del sistema inmunitario durante una infección que se asemeja a una encefalitis autoinmune2. Esta condición es extremadamente rara, con una incidencia de 1 entre 1.000.0003.
En el estadio agudo, el estado epiléptico es refractario al tratamiento. A continuación se produce un estadio crónico de epilepsia intratable4,5.
El FIRES tiene una tasa de mortalidad de hasta el 30%4,6. Los supervivientes desarrollan problemas de aprendizaje y tienen secuelas neurológicas6,7.
El propósito de este artículo es revisar e ilustrar los hallazgos de neuroimagen visualizados en una población con diagnóstico de FIRES en nuestra institución, realizados con resonadores de 1.5 Tesla (Siemens MAGNETOM Avanto®; Siemens Medical Solutions, Erlangen, Alemania) y resonador 3 Tesla (Ingenia®; Philips Healthcare, Best, Países Bajos). Además, se describirán diagnósticos diferenciales con FIRES.
Presentación clínica
Se presenta generalmente en niños previamente sanos entre tres y 15 años, con una media de 6,5 años. Tiene predilección por el sexo masculino4.
En el estadio agudo, las convulsiones son breves, aumentando gradualmente hacia el estado refractario epiléptico, el cual se define como crisis que persisten por más de 60 a 90 minutos después de iniciada la terapia, o tras el tratamiento adecuado con benzodiazepinas más una dosis adecuada de fármacos de segunda línea8. Este estadio puede durar entre una y 12 semanas, seguido de un estadio crónico caracterizado por una epilepsia refractaria3.
Hallazgos en resonancia magnética
Estadio agudo
Las imágenes cerebrales suelen ser normales hasta en el 61% de los casos9. El papel principal de la radiología es excluir cualquier otra causa estructural de estado epiléptico, como una malformación cortical, un accidente cerebrovascular, trastornos metabólicos o una neoplasia9.
Los hallazgos anormales de la resonancia magnética (RM) incluyen alteración de la señal en lóbulos temporales (señal hiperintensa en secuencia ponderada en T2 y FLAIR), ganglios basales, tálamos o tronco encefálico, edema cerebral difuso, así como restricción laminar cortical en secuencias de difusión (Fig. 1 y Fig. 2).
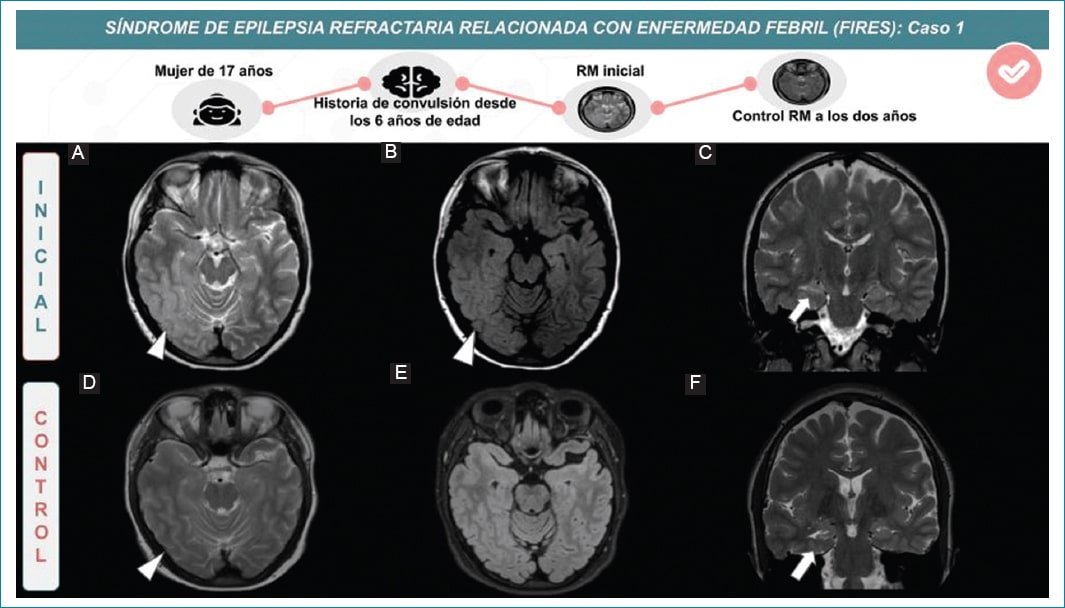
Figura 1. Mujer de 17 años con antecedentes de convulsión febril desde los seis años. RM inicial (A, B y C) presenta señal hiperintensa en secuencia ponderada en T2 y FLAIR en región temporal (cabeza de flecha) e hipocampal anterior derecho (flecha). En el control (D, E y F), dos años después, se identifica discreta atrofia difusa (punta de flecha) más evidente a nivel temporo-mesial (F) (flecha).
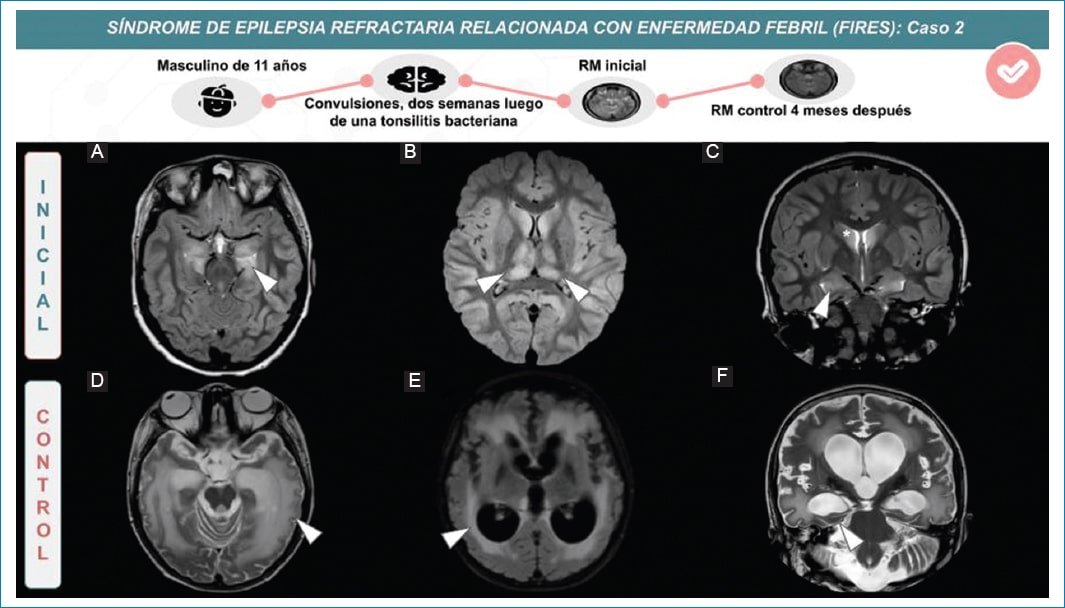
Figura 2. Varón de 11 años con convulsiones a las dos semanas de instaurarse un cuadro de amigdalitis bacteriana. En imágenes iniciales se observa señal hiperintensa en secuencia ponderada en T2 (A-C) y FLAIR (B) y corteza tumefacta en áreas fronto-temporo-parietales de ambos hemisferios (cabezas de flechas). Control cuatro meses después presenta extensa señal hiperintensa de sustancia blanca subcortical y periventricular de ambos hemisferios en secuencia ponderada en T2 y FLAIR (D y E). También se observa atrofia difusa que incluye estructuras temporo-mesiales (F).
La anomalía aguda más común es la afectación de lóbulos temporales (incluyendo las estructuras del lóbulo temporo-mesial y el hipocampo), de forma unilateral o bilateral. Los cambios de señal pueden afectar estructuras como la ínsula o ganglios basales. En secuencia de difusión se puede llegar a observar restricción de la misma9 (Fig. 3).
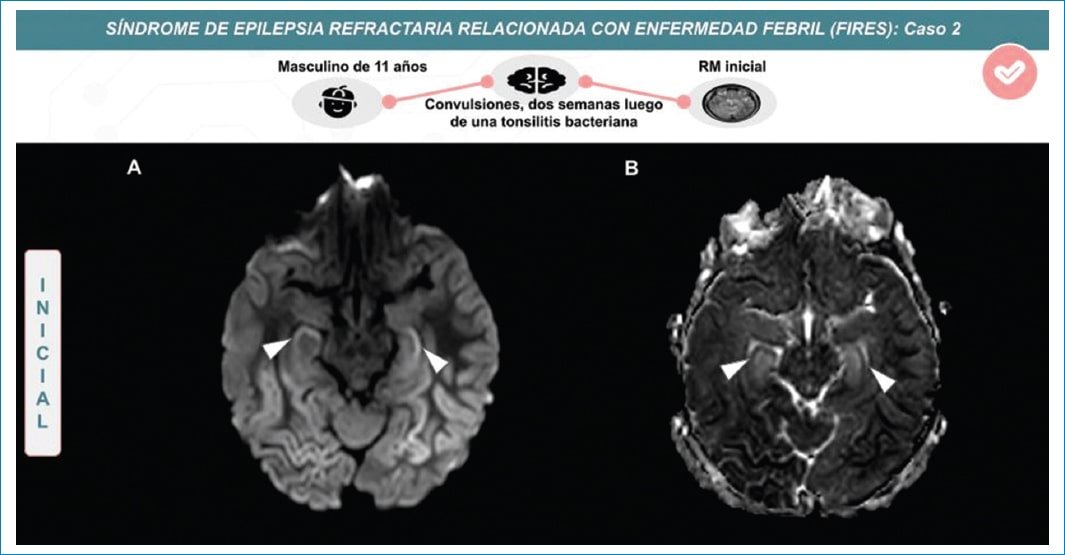
Figura 3. Mismo paciente de la figura 2, donde se muestra en secuencia de difusión (A) y mapa de ADC (B) restricción cortical de la región del hipocampo en secuencias de difusión (cabeza de flecha).
Los cambios menos frecuentes que se han notificado en menos del 5% incluyen edema cortical en otros lóbulos, realce leptomeníngeo, señal hiperintensa en secuencia ponderada en T2 a nivel talámico, anomalías del tronco cerebral, infartos subcorticales multifocales y edema o hemorragia cerebelosa10.
Fase crónica
Puede caracterizarse con atrofia encefálica, que incluye ventriculomegalia (49,4%) y esclerosis temporo-mesial (24,7%). La atrofia cerebelosa se notificó en el 3,1% de los pacientes9. Dichos hallazgos pueden identificarse a partir de la segunda a tercera semana de inicio de la enfermedad11 (Fig. 1 y Fig. 2).
Imágenes cerebrales sin hallazgos vinculables a la enfermedad son visibles hasta en un 18,5%9. Otros hallazgos incluyen señal hiperintensa en secuencia ponderada en T2 y FLAIR de la sustancia blanca periventricular, ínsula, ganglios de la base y tálamo. Se ha postulado que representa una desmielinización focal transitoria. El mal resultado clínico se correlacionó con peores cambios de señal periventricular. Es controversial si dichos cambios se deben a convulsiones prolongadas o a la propia entidad de la enfermedad12.
Entre los hallazgos poco comunes se encuentran el realce ependimario, aumento de la señal que afectan a la sustancia gris y a los tractos corticoespinales, y la evolución crónica de múltiples infartos subcorticales.
La espectroscopia por RM cerebral muestra un pequeño pico de lactato, hallazgos con un valor inespecífico (Fig. 4)13.
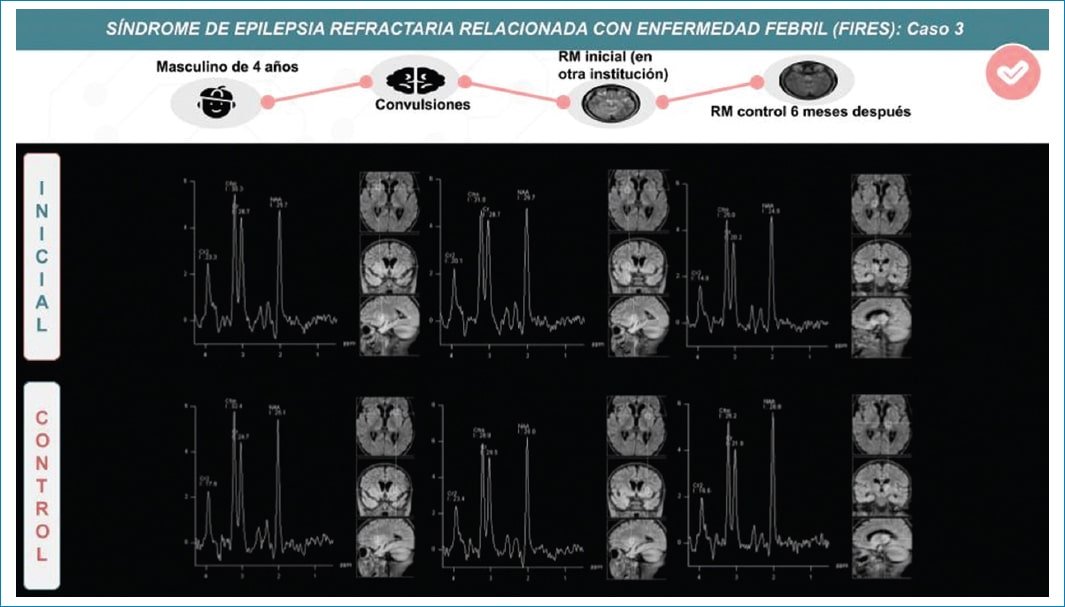
Figura 4. Varón de cuatro años en estudio por epilepsia refractaria. La espectroscopia de RM muestra una disminución difusa de aspartato de N-acetilo en el parénquima afectado.
Diagnósticos diferenciales
ENCEFALITIS LÍMBICA
Encefalopatía rápidamente progresiva (normalmente en menos de seis semanas) causada por una inflamación cerebral14 con compromiso de los lóbulos temporo-mesiales y el sistema límbico, manifestándose típicamente por un engrosamiento cortical y un aumento de la intensidad de la señal en secuencia ponderada en T2 y FLAIR (Fig. 5). Estos hallazgos suelen ser bilaterales, pero asimétricos15.
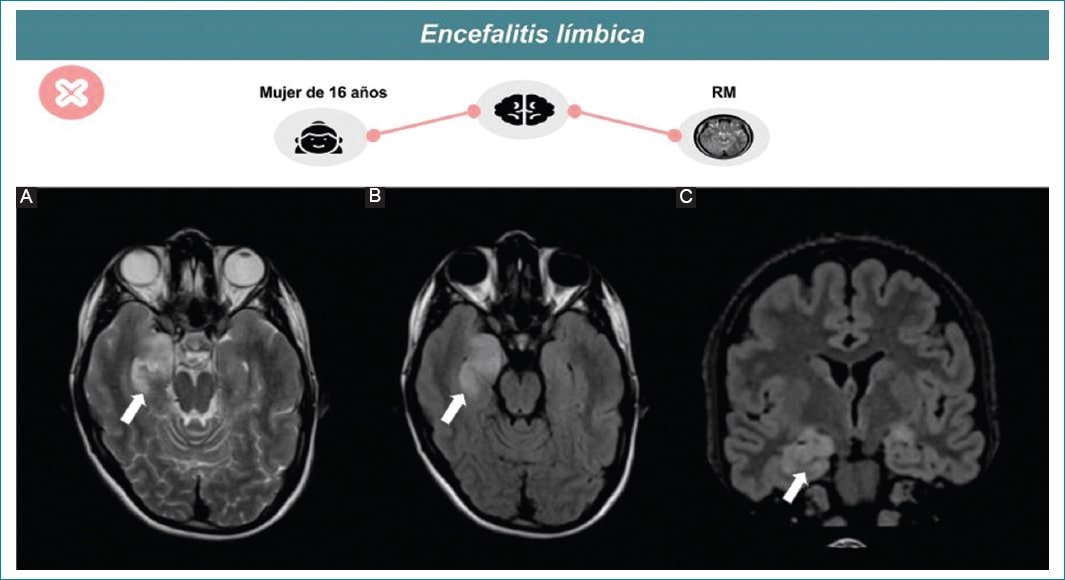
Figura 5. Encefalitis límbica en una mujer de 16 años. Señal hiperintensa ponderada en T2 (A) y FLAIR (B, C) en ambos hipocampos, de predominio derecho (flecha).
ENCEFALOMIELITIS AGUDA DISEMINADA
La encefalomielitis aguda diseminada (ADEM) es una enfermedad inmunomediada que produce múltiples lesiones inflamatorias en el cerebro y la médula espinal16.
Las lesiones desmielinizantes se visualizan mejor por RM (Fig. 6). Predomina la afectación de la sustancia blanca, pero también puede verse afectada la sustancia gris, en particular ganglios basales, tálamos y tronco encefálico16. Estas lesiones son bilaterales, asimétricas, mal delimitadas y suelen presentar efecto de masa. En secuencias ponderadas en T2 y FLAIR se presentan como áreas parcheadas de aumento de la intensidad de la señal. Para considerar esta entidad, las lesiones en RM deben tener el mismo tiempo evolutivo, sin observarse nuevas lesiones en los estudios de control después del ataque clínico inicial17.
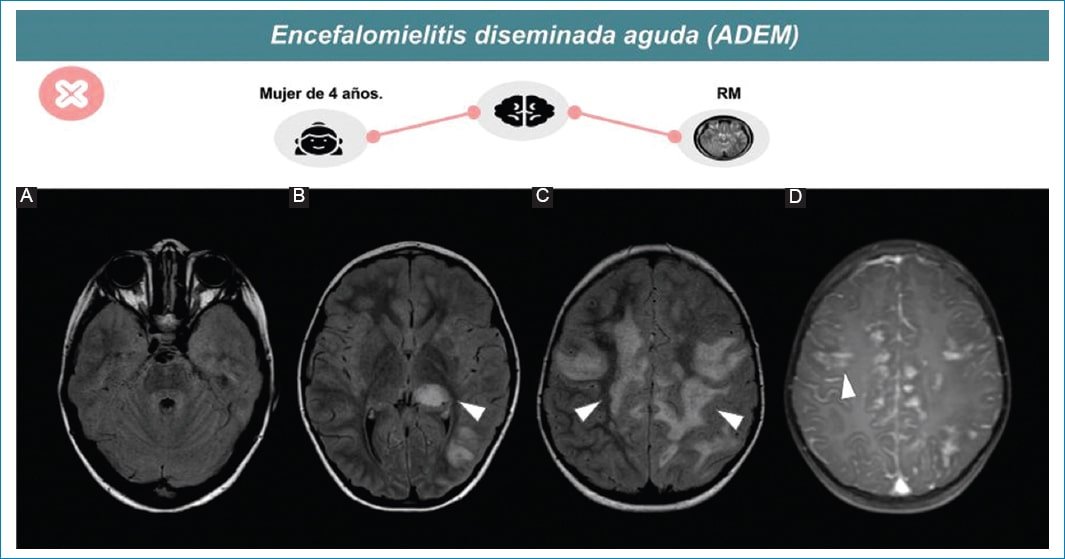
Figura 6. ADEM en una niña de cuatro años. Señal hiperintensa en FLAIR (A-C) de sustancia blanca subcortical y periventricular de ambos hemisferios, así como tálamo izquierdo (flechas). Las lesiones presentan ligero realce tras la administración de gadolinio (puntas de flecha) (D).
Conclusiones
El FIRES es una entidad catastrófica con muchas complicaciones y secuelas irreversibles.
Por ende, el radiólogo debe aportar desde su campo estas anomalías en la RM para respaldar el diagnóstico de FIRES, ya que se trata de un diagnóstico de exclusión.
Financiamiento
Los autores declaran no haber recibido financiamiento para este estudio.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Uso de inteligencia artificial para generar textos. Los autores declaran que no han utilizado ningún tipo de inteligencia artificial generativa en la redacción de este manuscrito ni para la creación de figuras, gráficos, tablas o sus correspondientes pies o leyendas.