Introducción
Las anomalías de la vena cava inferior (VCI) y sus variantes fueron descriptas por primera vez por Abernethy en 1793, en un paciente de 10 meses de edad con poliesplenia y dextrocardia que presentaba un shunt congénito mesocavo y continuación de la vena cava con la ácigos1. Representan un amplio espectro de patologías que se pueden encontrar en hasta un 8,7% de la población general. La génesis de estas entidades se remite al desarrollo embriológico que involucra anastomosis complejas y regresiones de venas embrionarias, procesos que ocurren durante la cuarta a octava semana de gestación2,3.
El rol de las imágenes, fundamentalmente mediante tomografía computada multislice (TCMS), es crucial para la detección y caracterización. Si bien la mayor parte de las entidades son asintomáticas e incidentales, en muchos casos pueden tener repercusión clínico-patológica directa, simular otras patologías o representar un desafío en la planificación de intervenciones vasculares3. Además, pueden condicionar la presencia de insuficiencia venosa en miembros inferiores, trombosis venosa profunda y síndrome de congestión pelviana4–6.
El objetivo de este ensayo es describir las diferentes entidades congénitas que involucran a la VCI y sus tributarias, tomando en consideración su correlato embriológico y su representación mediante TCMS.
Técnicas de imagen
La ecografía con Doppler color es una modalidad útil en evaluación inicial. Sin embargo, es dependiente del operador y la visualización de la VCI puede ser limitada debido a interposición gaseosa o biotipo adverso del paciente7.
Teniendo en cuenta que la TCMS se utiliza en múltiples ocasiones para la evaluación de cuadros abdominales, es habitual que sea esta la técnica por la cual se detectan por primera vez, de forma incidental, muchas de estas entidades3. En dicho contexto, la obtención de imágenes se realiza comúnmente luego de los 60-70 segundos de la inyección del contraste endovenoso, lo que permite una correcta tinción de la porción suprarrenal de la VCI. No obstante, las adquisiciones entre los 70 y 90 segundos pueden aportar una mejor opacificación de los segmentos infrarrenales de la VCI8.
Las ventajas de la TCMS son su alta resolución espacial, que permite la obtención de imágenes con información isotrópica, y también cuenta con herramientas que permiten reconstrucciones posprocesamiento de imágenes, como volúmenes 3D o reconstrucciones en máxima intensidad de proyección (MIP)2,8.
La resonancia magnética (RM) es una alternativa válida particularmente en el contexto de pacientes que no pueden recibir contraste iodado. La ausencia de radiación ionizante es otra particularidad en el contexto de la población pediátrica y adultos jóvenes8.
Embriogénesis de la VCI
La VCI definitiva se compone de cuatro segmentos: hepático, suprarrenal, renal e infrarrenal. La génesis de la VCI involucra diferentes procesos que incluyen formación de anastomosis y regresiones de estructuras venosas embrionarias3. Las anomalías congénitas de la VCI son resultado de la persistencia o regresión anómala de estas estructuras venosas fetales9.
Estas últimas se constituyen principalmente por la vena vitelina y una serie de venas pares, ubicadas a cada lado de la línea media, incluyendo las venas cardinales posteriores, subcardinales y supracardinales.
El segmento hepático de la VCI deriva de la vena vitelina derecha. La VCI suprarrenal surge del segmento craneal de la vena subcardinal derecha. La anastomosis entre las venas supracardinales, posteriormente, y las venas subcardinales, anteriormente, constituye el segmento renal de la VCI10. Una porción de la vena supracardinal derecha persiste como el segmento infrarrenal de la VCI. Las venas cardinales posteriores (las porciones caudales) se transforman en las venas ilíacas. Por último, el sistema ácigos es el resultado de la persistencia de las venas supracardinales superiores (Fig. 1)3.
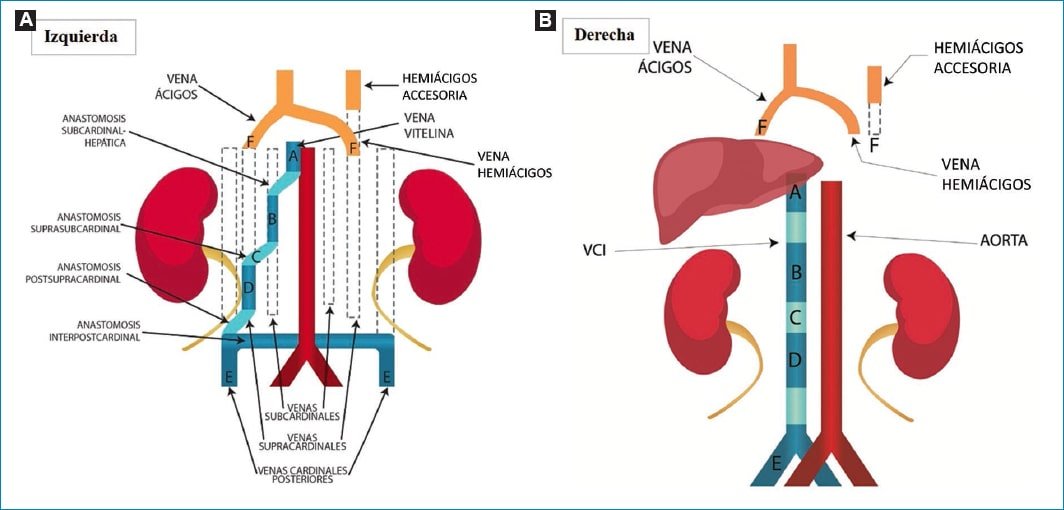
Figura 1. Diagrama de la embriogénesis de la VCI (izquierda) y la configuración anatómica normal final del adulto (derecha). La VCI madura (azul oscuro) está compuesta de cuatro segmentos (hepático, suprarrenal, renal e infrarrenal), los cuales surgen a partir de la formación de anastomosis (celeste) y regresiones de venas embrionarias. El segmento hepático de la VCI deriva de la vena vitelina derecha (A). La VCI suprarrenal surge del segmento craneal de la vena subcardinal derecha (B). La anastomosis suprasubcardinal (C) constituirá el segmento renal. Una parte de la vena supracardinal derecha (D) persiste como el segmento infrarrenal. Las porciones caudales de las venas cardinales posteriores (E) se transforman en venas ilíacas. El sistema ácigos resulta de la persistencia de las venas supracardinales superiores (F).
Agenesia de la VCI
La ausencia de VCI es rara e incluye dos variantes: ausencia de VCI infrarrenal con preservación del segmento suprarrenal o ausencia completa de VCI2. Esta última sugiere que existe una falla en el desarrollo de los tres pares de venas embrionarias, mientras que la primera implica una alteración en la génesis de las venas cardinales posteriores y supracardinales. Es complejo establecer un único evento embriológico, por lo que se plantea que pueda ser resultado de trombosis venosa perinatológica11,12. El retorno venoso en estos pacientes ocurre a través de venas lumbares ascendentes que drenan hacia el sistema ácigos y hemiácigos, dando como resultado colateralidad prominente de estructuras venosas que pueden simular masas paraespinales (Fig. 2)7,13.
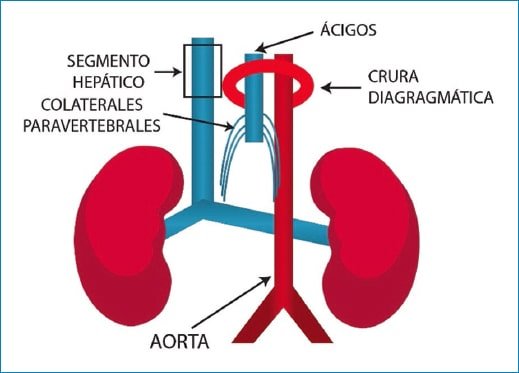
Figura 2. Esquema de la agenesia de la VCI.
Duplicación de la VCI
Es el resultado de la persistencia de ambas venas supracardinales3. Tiene una prevalencia del 0,2-3%11. La identificación de esta entidad tiene vital importancia en el contexto de pacientes candidatos a colocación de filtros de VCI, dado que su desconocimiento puede desembocar en el desarrollo recurrente de tromboembolia pulmonar (Fig. 3)3.
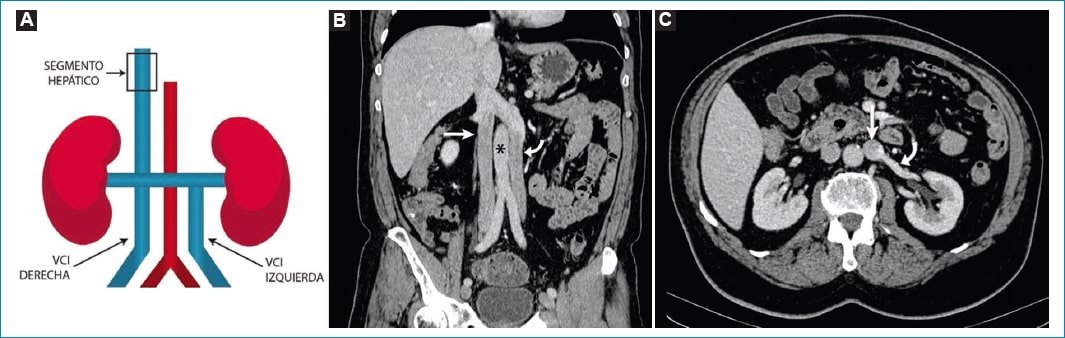
Figura 3. Duplicación de VCI. A: el diagrama muestra la VCI derecha e izquierda y la convergencia de la VRI a esta última. B: corte coronal tomográfico con contraste endovenoso demostrando la duplicación de la VCI, a la derecha (flecha recta) e izquierda (flecha curva) de la aorta (asterisco), y su convergencia a nivel suprarrenal. C: corte axial, visualizándose doble VCI con VRI (flecha curva) drenando en la VCI homolateral (flecha recta).
VCI izquierda
Su prevalencia va del 0,2 al 0,5%10. Es secundaria a regresión de la vena supracardinal derecha y persistencia anómala de la vena supracardinal izquierda3. Tiene un curso craneal izquierdo a lo largo de la aorta abdominal, se une a la vena renal izquierda (VRI) y en conjunto toman un curso anterior para drenar finalmente en una VCI suprarrenal normal (Fig. 4)3,7. No tiene importancia clínica en sí misma; no obstante, puede imitar adenopatías paraaórticas7,14.
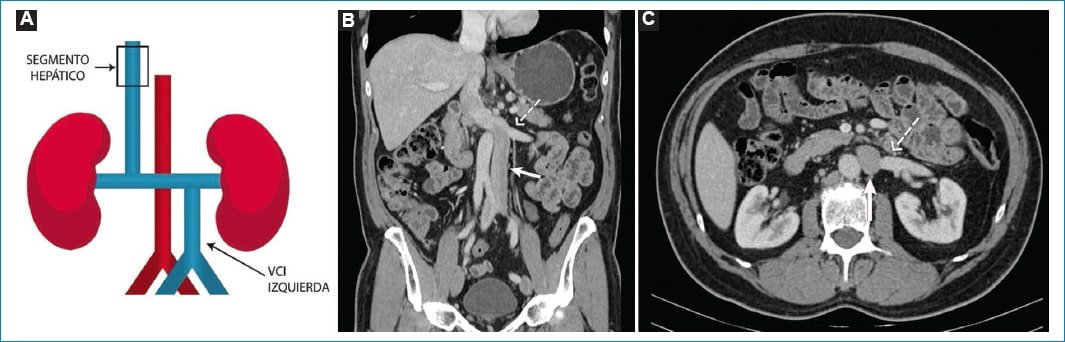
Figura 4. VCI izquierda. A: el diagrama ejemplifica a la VCI a la izquierda de la aorta desembocando en la vena renal homolateral. B y C: cortes coronal y axial respectivamente de TC con contraste endovenoso. VCI a la izquierda (flecha recta) y su convergencia con la venal renal homolateral (flecha discontinua).
Continuación anómala de la VCI
Se produce como consecuencia de una falla embriológica al formar la anastomosis subcardinal derecha hepática. La VCI suprarrenal drena en el sistema ácigos-hemiácigos para retornar al corazón a través de la vena cava superior. Debido a la ausencia del segmento intrahepático de la VCI, las venas suprahepáticas desembocan de manera directa a la aurícula derecha3 (Fig. 5). La vena ácigos suele estar dilatada y puede simular una masa paratraqueal o adenopatías retrocrurales10,15. También hay que considerar la posibilidad de una ligadura accidental durante el contexto de una cirugía torácica, que desencadenaría en un evento fatal para el paciente10. Es imperativo tener en cuenta esta variante previa planificación de un bypass cardiopulmonar10,16. La asociación más común con esta anomalía incluye a los síndromes heterotáxicos (isomerismo izquierdo) y la malrotación intestinal17.
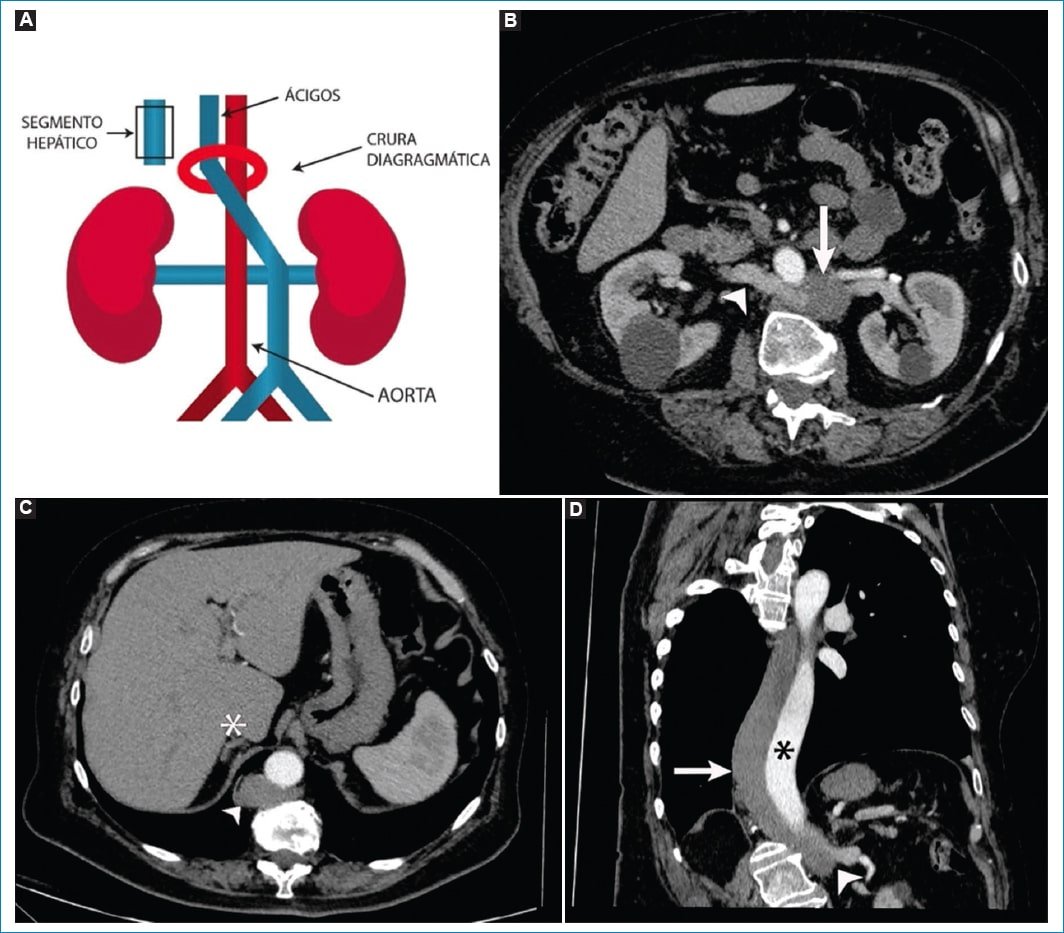
Figura 5. Continuación anómala de la VCI. A: el esquema demuestra localización izquierda de la VCI, con ausencia del segmento hepático y drenaje anómalo al sistema ácigos. B: corte axial tomográfico con la VCI a la izquierda (flecha recta) mostrando la vena renal derecha un recorrido retroaórtico (cabeza de flecha). C: corte axial visualizándose ausencia del segmento hepático de la VCI (asterisco) y vena ácigos prominente (cabeza de flecha). D: corte coronal oblicuo. Dilatación de la vena ácigos (flecha recta) acompañando el recorrido de la aorta descendente (asterisco) a expensas de drenaje anómalo de VCI izquierda (cabeza de flecha).
Uréter retrocavo
A diferencia de la anatomía habitual de la VCI infrarrenal que surge de la vena supracardinal derecha (localizada posteromedial con respecto al uréter homolateral), en esta entidad la VCI infrarrenal se desarrolla a partir de la vena cardinal posterior derecha (que discurre anterior y lateral con respecto al uréter). Como resultado, el uréter proximal queda confinado posteriormente con respecto a la VCI, pudiendo generar compresión y consecuente hidronefrosis y/o infecciones urinarias recurrentes (Fig. 6)16. Tiene una prevalencia del 0,06 al 0,17%, ocurriendo más comúnmente en hombres, del lado derecho10,18.
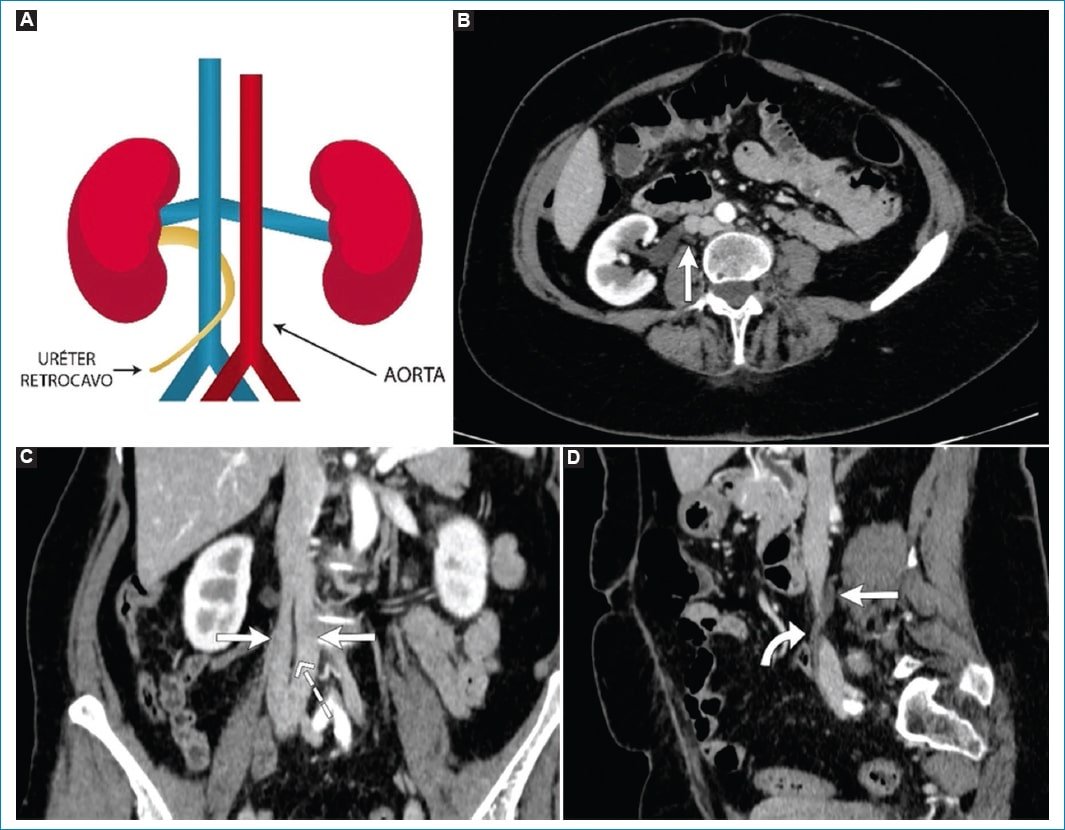
Figura 6. A: diagrama del uréter retrocavo. B: corte axial oblicuo con recorrido ureteral derecho posterior a la VCI (flecha recta). C: corte coronal oblicuo que muestra asociación con duplicación incompleta derecha de la VCI, quedando el uréter (flecha discontinua) confinado dentro de esta y conformando un “anillo periureteral” (flechas rectas). D: corte sagital oblicuo que demuestra al tercio proximal del uréter de recorrido retrocavo (flecha recta), que toma curso anterior a la VCI luego de cruzar el anillo (flecha curva).
Obstrucción membranosa de la VCI intrahepática
Aunque es raro en la mayor parte de los países del mundo, la obstrucción membranosa de la VCI es la causa más común de obstrucción del flujo venoso hepático en Asia y Sudáfrica. Se expresa como una lesión oclusiva de la VCI generalmente completa, pero ocasionalmente con un pequeño orificio central, ubicándose en proximidad al ingreso en la aurícula derecha o inmediatamente por debajo del diafragma. La causa permanece incierta, aunque se han planteado dos posibles orígenes: resultado de una malformación congénita vascular o secuela de trombosis en la porción hepática de la VCI19. Puede desarrollarse colateralidad prominente, intrahepática y extrahepática, y clínicamente puede causar obstrucción del flujo hepático, síndrome de Budd-Chiari congénito y carcinoma hepatocelular3.
Shunt portocavo extrahepático (malformación de Abernethy)
La malformación de Abernethy, también conocida como shunt portosistémico extrahepático congénito (SPEC), es una condición rara en donde la sangre portal drena parcial o completamente a la circulación sistémica a través de una comunicación anormal. Embriológicamente, la vena porta (VP) se desarrolla a partir de la vena vitelina derecha e izquierda y de anastomosis intervitelinas alrededor del duodeno. La regresión selectiva de los canales anastomóticos forma la VP. Se piensa que estos shunts extrahepáticos se deben a una involución excesiva de la vena vitelina o a la falla de la vena vitelina para establecer anastomosis con los sinusoides hepáticos o venas suprahepáticas3. Se clasifica en dos categorías20:
- Tipo 1 (completa): se caracteriza por un shunt completo entre la sangre portal en la VCI y una ausencia congénita de la VP. A su vez, estas se dividen en dos subtipos:
- Ia: en donde la vena esplénica (VE) y vena mesentérica superior (VMS) drenan de manera independiente hacia una vena sistémica.
- Ib: la VE y la VMS forman un tronco común que drenan en una vena sistémica21.
- Tipo 2 (parcial): anastomosis parcial entre una VP intacta y la VCI3.
- En los shunts tipo 1, la VP drena extrahepáticamente en la VCI en cualquier punto inferior a la confluencia de las venas suprahepáticas. Sin embargo, se han descripto casos en donde la VP drena de manera directa a la VCI suprahepática o a la aurícula derecha (Fig. 7)22,23.
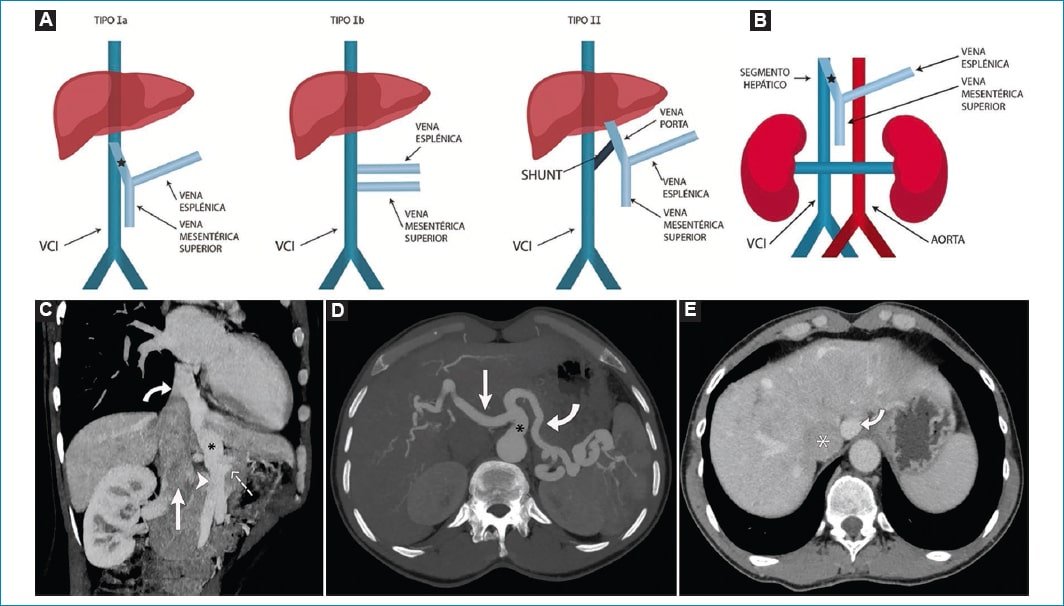
Figura 7. A: esquema de los diferentes tipos de malformación de Abernethy. B: esquematización del shunt portocavo extrahepático, donde se observa una VE y VMS que convergen en un tronco común (asterisco) y desemboca en la VCI suprahepática (flecha). C: reconstrucción MIP en plano coronal oblicuo. VCI de disposición habitual (flecha recta). VMS (cabeza de flecha) que, en conjunto con la VE (flecha discontinua) forman un tronco común (asterisco) que drena en la VCI suprahepática (flecha curva). D: reconstrucción MIP en plano axial, donde se puede visualizar prominencia del tronco celíaco (asterisco), arteria hepática (flecha recta) y arteria esplénica (flecha curva). E: corte axial tomográfico, inmediatamente caudal a la convergencia entre la VCI (asterisco) y la vena porta extrahepática anormal (flecha curva). También se puede apreciar un patrón de realce poscontraste heterogéneo del parénquima hepático, generado por alteración de la perfusión propia de la entidad.
La repercusión clínica de los SPEC se puede dividir en aquellos que son consecuencia del shunt de la circulación portal (síndrome hepatopulmonar, disfunción metabólica y encefalopatía hepática), las anomalías congénitas asociadas (cardiacas, arterio-venosas, viscerales y musculoesqueléticas), y las secundarias a lesiones hepáticas (nódulos regenerativos, hiperplasia nodular focal, hepatocarcinoma, entre otras)21.
Anomalías de las venas tributarias (VRI retroaórtica y circumaórtica)
Las anomalías de la VCI incluyen también otras variantes derivadas de las venas tributarias. Normalmente, la VRI deriva de anastomosis intersubcardinales que cruzan anteriormente a la aorta.
La VRI es retroaórtica cuando deriva de venas intersupracardinales, las cuales se posicionan posterior con respecto a la aorta. Ocurre en un 1,7-3,4% de los individuos (Fig. 8).
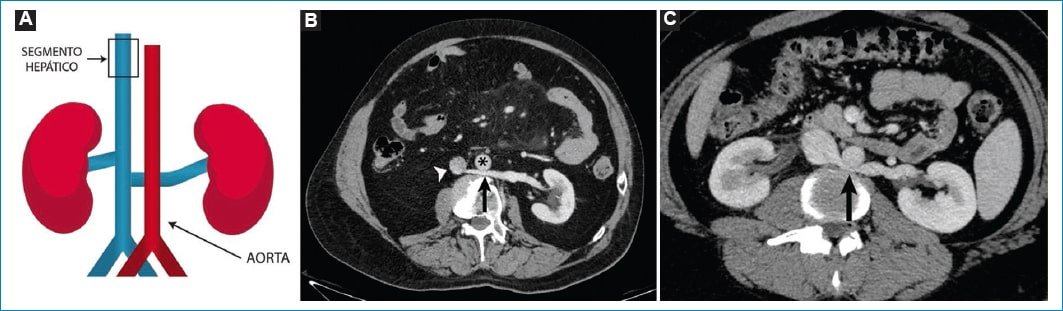
Figura 8. Variante de las tributarias: VRI retroaórtica. A: esquema de la VRI con disposición retroaórtica. B: corte axial oblicuo de TC, donde se advierte el recorrido posterior con respecto a la aorta (asterisco) de la VRI (flecha recta), y su confluencia a la VCI (cabeza de flecha). C: corte axial de TC en otro paciente, con el mismo hallazgo y discreta compresión de la VRI por parte de la aorta (flecha recta).
La persistencia tanto de venas intersupracardinales como de las intersubcardinales resulta en un anillo venoso circumaórtico (una vena anterior y otra posterior a la aorta). La prevalencia es del 2,4-8,7% (Fig. 9).
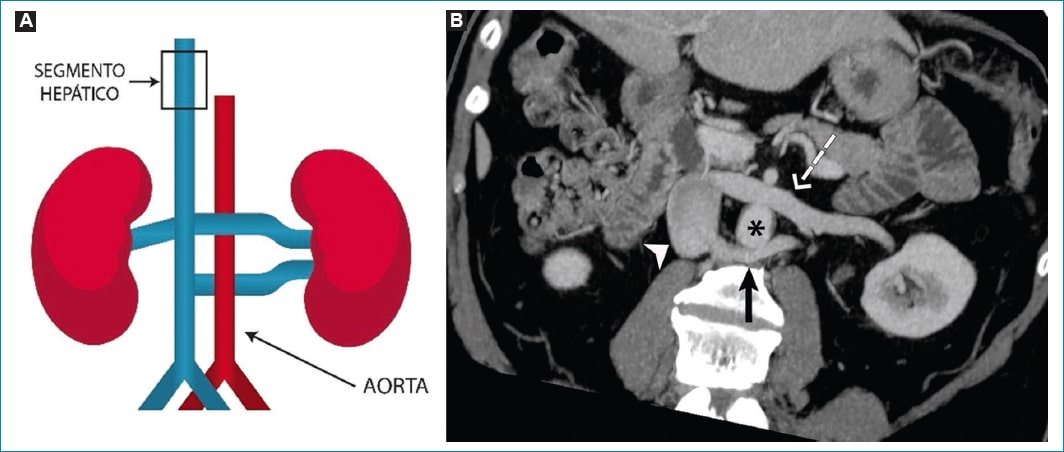
Figura 9. Variante de las tributarias: VRI circumaórtica. A: esquema de la VRI con recorrido cirumaórtico. B: reconstrucción MIP en plano axial oblicuo. Bifurcación del recorrido de la VRI, con una rama anterior (flecha discontinua) y otra posterior (flecha recta) con respecto a la aorta (asterisco), que drenan en la VCI (cabeza de flecha).
Dichas variantes asumen un significado importante en la planificación preoperatoria de nefrectomía. También pueden imitar adenopatías. En raras ocasiones, puede existir compresión de la vena renal en su curso posterior y resultar en insuficiencia venosa periureteral y hematuria, entre otros7.
Conclusión
Las técnicas de imagen tienen un rol fundamental en la detección de las diferentes anomalías congénitas de la VCI. Su correcta caracterización, principalmente mediante tomografía computada (TC) con contraste endovenoso, es crucial, ya que puede tener implicancias clínicas directas, imitar otras enfermedades o plantear desafíos en la planificación de intervenciones vasculares.
Financiamiento
Los autores declaran no haber recibido financiamiento para este estudio.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Uso de inteligencia artificial para generar textos. Los autores declaran que no han utilizado ningún tipo de inteligencia artificial generativa en la redacción de este manuscrito ni para la creación de figuras, gráficos, tablas o sus correspondientes pies o leyendas.