Introducción
La resonancia magnética (RM) se ha posicionado en las últimas décadas como indispensable en el diagnóstico y la estadificación del cáncer de recto. Diferenciar los tumores tempranos de aquellos considerados localmente avanzados permite determinar un tratamiento quirúrgico o neoadyuvante, respectivamente.
Es ampliamente conocido que la radioquimioterapia constituye el tratamiento neoadyuvante de elección para el cáncer de recto localmente avanzado1. Históricamente, aquellos que logren una buena respuesta al mismo son candidatos a resección mesorrectal total con intención curativa. Sin embargo, la posibilidad de implementar un tratamiento conservador frente a la alternativa quirúrgica ha ido incrementándose desde su primera descripción por Habr-gama et al.2 en 1998. Este tratamiento consiste en un esquema de vigilancia activa, conocido como watch and wait (WW), que permite a estos pacientes la preservación del órgano evitando así la comorbilidad que la cirugía acarrea.
Es importante consignar algunos conceptos básicos previos a describir estrictamente la valoración por RM de la estrategia WW.
Indicación de watch and wait
Si bien no existen claras indicaciones ni contraindicaciones para el empleo de WW, esta estrategia aplica usualmente a pacientes que cumplan dos criterios: 1) presentar cáncer de recto inferior y 2) haber alcanzado una respuesta clínica completa. La razón del primero radica en que el tumor de recto inferior acarrea mayor riesgo de ostoma transitorio o persistente, y un peor pronóstico funcional global, además de que debe ser accesible por todos los métodos de vigilancia (RM, examen rectal digital y endoscopía). En este aspecto de la accesibilidad entra el segundo requisito, la respuesta clínica completa, que se define como la ausencia clínica, endoscópica y radiológica de tumor residual luego de algún esquema de neoadyuvancia3.
Recrecimiento tumoral vs. recurrencia tumoral
Cabe diferenciar los términos “recrecimiento” y “recurrencia”. El recrecimiento tumoral es un término utilizado exclusivamente en el WW y se aplica en aquellos pacientes que han logrado una respuesta clínica completa y luego tienen una recidiva, ya sea en la pared rectal, en el mesorrecto o en los ganglios ilíacos internos. La recurrencia tumoral, por su parte, se emplea para aquellos pacientes que han tenido una resección mesorrectal total u otra exéresis quirúrgica4.
La principal importancia de diferenciar estos términos radica en el pronóstico. En el recrecimiento tumoral se estima un mejor pronóstico global, dado que se da dentro de un programa de detección temprana y es posible un rescate quirúrgico con intención curativa. Por el contrario, la recurrencia tumoral se aplica a un paciente en el cual se ha intentado la resección quirúrgica curativa, por lo que la recidiva tumoral se entiende como un fracaso del tratamiento y así tiene un peor pronóstico global.
Protocolo de estudio
En nuestra institución, el protocolo de estudio por RM incluye la preparación con un enema evacuatorio 3 a 4 horas antes del examen y la administración de un agente antiespasmódico (butilbromuro de hioscina) por vía intramuscular inmediatamente antes de iniciarlo. Se recomiendan campos de 1,5 T en adelante.
El estudio se inicia con secuencias potenciadas en T2 sagital y axial, con un FoV (field of view) amplio, orientadas a la pelvis, y un grosor de corte de 3 mm, buscando identificar la lesión en seguimiento. Una vez ubicada esta, se programan cortes axiales y coronales T2 de alta resolución (T2HR) orientados al tumor. Con la misma programación que el axial T2HR se realizan secuencias de difusión (DWI, diffusion-weighted imaging) y mapa de coeficiente de difusión aparente (ADC, apparent diffusion coefficient), útiles en el seguimiento de los pacientes bajo este esquema5.
La administración de gel endorrectal se realiza sistemáticamente en nuestra institución, logrando aumentar la sensibilidad diagnóstica de pequeñas lesiones parietales6. El uso de gadolinio no está incluido en nuestro protocolo habitual, salvo indicaciones precisas, como sospecha de colecciones o fístulas.
Por último, es menester conocer cómo va a emplearse el WW. Las diferentes guías recomiendan un seguimiento cada 8-12 semanas por los tres métodos durante los primeros 3 años desde la respuesta clínica completa, ya que en más del 90% de los casos el recrecimiento tumoral se da dentro de este período7. Pasado este tiempo, el riesgo de recrecimiento es menor del 5%, por lo que la vigilancia se realiza semestralmente durante 3 a 5 años. Si bien luego de los primeros 5 años es infrecuente el recrecimiento, se recomienda un seguimiento anual de por vida3.
Recrecimiento tumoral. Valoración por resonancia magnética
La respuesta radiológica completa, es decir, la respuesta clínica completa desde un punto de vista radiológico, se describe clásicamente como un área de baja señal en el sitio donde asentaba el tumor e inclusive más profundo que este, en relación a campos fibrosos posactínicos (Fig. 1). La cantidad de fibrosis puede ser estimada mediante diferentes sistemas; el de mayor aceptación es el sistema de regresión tumoral (TRG, tumor regression grading system), que ha demostrado una buena correlación entre los hallazgos por RM y el pronóstico oncológico8 (Fig. 2).
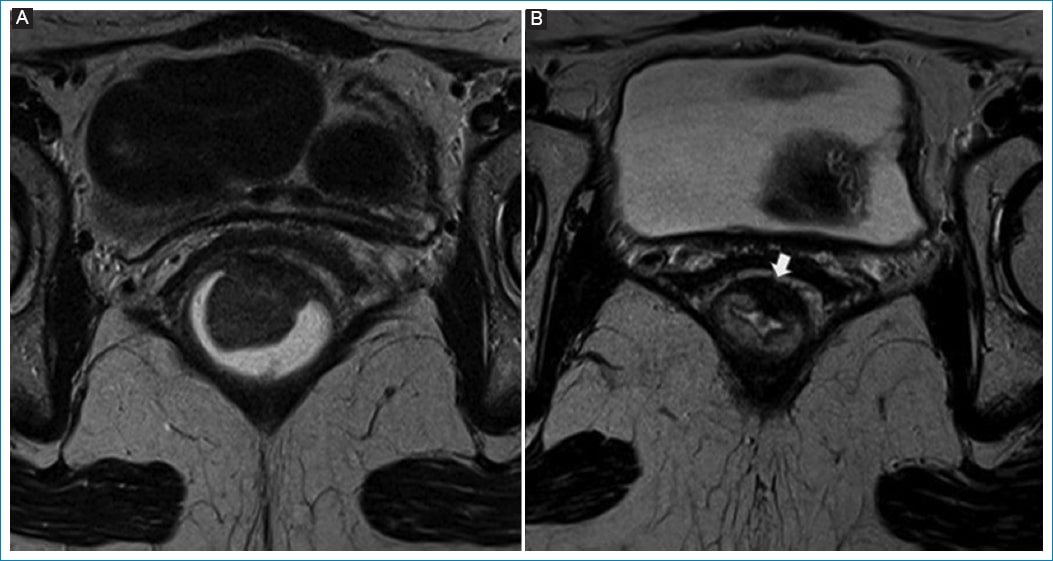
Figura 1. Regresión tumoral. Respuesta radiológica completa. Mujer de 50 años con adenocarcinoma infiltrante. A: tumor de recto inferior con crecimiento vegetante y compromiso de la muscular (T3). B: RM de control 9 semanas posterior al tratamiento neoadyuvante. Se evidencia regresión total del tumor, con desarrollo de un área de baja señal en el sitio donde asentaba en relación con cambios posactínicos (flecha). Sin signos de restricción (no mostrado).
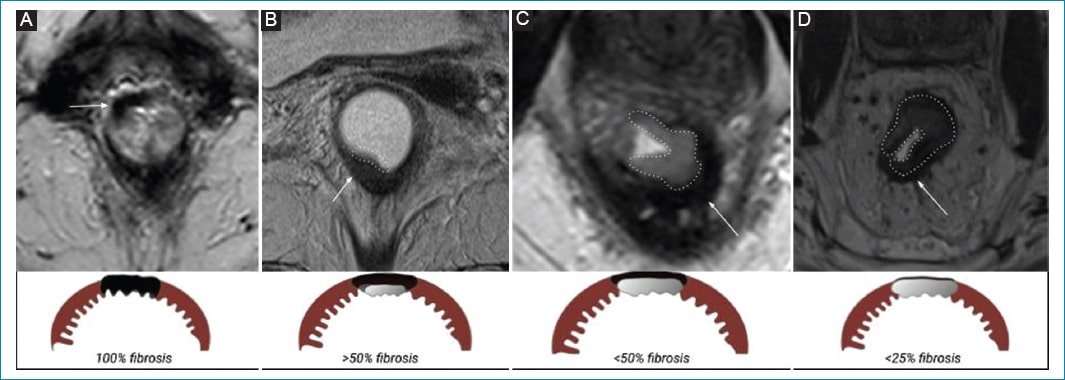
Figura 2. Los grados de regresión tumoral posterior a la neoadyuvancia se basan en la escala de Mandard adaptada a las imágenes (TRG, tumor regression grading system). A: respuesta completa: 100% fibrosis, sin evidencia de tumor residual. B: buena respuesta: > 50% fibrosis con persistencia de imagen de señal intermedia. C: respuesta moderada: < 50% fibrosis y mayor componente de señal intermedia. D: mala respuesta: < 25% fibrosis con marcado componente tumoral. Flecha blanca fina: fibrosis. Línea discontinua: tumor viable.
Durante el seguimiento, el recrecimiento tumoral puede presentar variadas formas. Con fines prácticos, aquí lo clasificaremos en dos grupos: intramurales (con o sin afectación mucosa) y extramurales cuando se desarrollan a partir de depósitos tumorales, ganglios mesorrectales o extramesorrectales. La gran mayoría (90%) son intramurales y tienen un componente endoluminal9, siendo los que se desarrollan a nivel del mesorrecto y los ganglios regionales menos del 10% de los casos. Cabe conocer esta distinción, ya que solo serán accesibles por el tacto rectal y la endoscopía aquellos que muestren un componente mucoso, dejando excluidos de estos métodos los que tengan un estricto componente intramural y los extramurales.
Recrecimiento intramural
Dentro de este primer grupo existen tres formas de determinar el recrecimiento tumoral. La primera es la aparición de un área de señal intermedia o una heterogeneidad de novo en el área cicatrizal posactínica. Esta es quizá la forma más evidente del recrecimiento y es accesible por todos los métodos de vigilancia (Fig. 3). Sin embargo, muchas veces el hallazgo puede ser muy sutil, por lo que se requieren una adecuada técnica y un análisis minucioso para su correcto diagnóstico (Fig. 4).
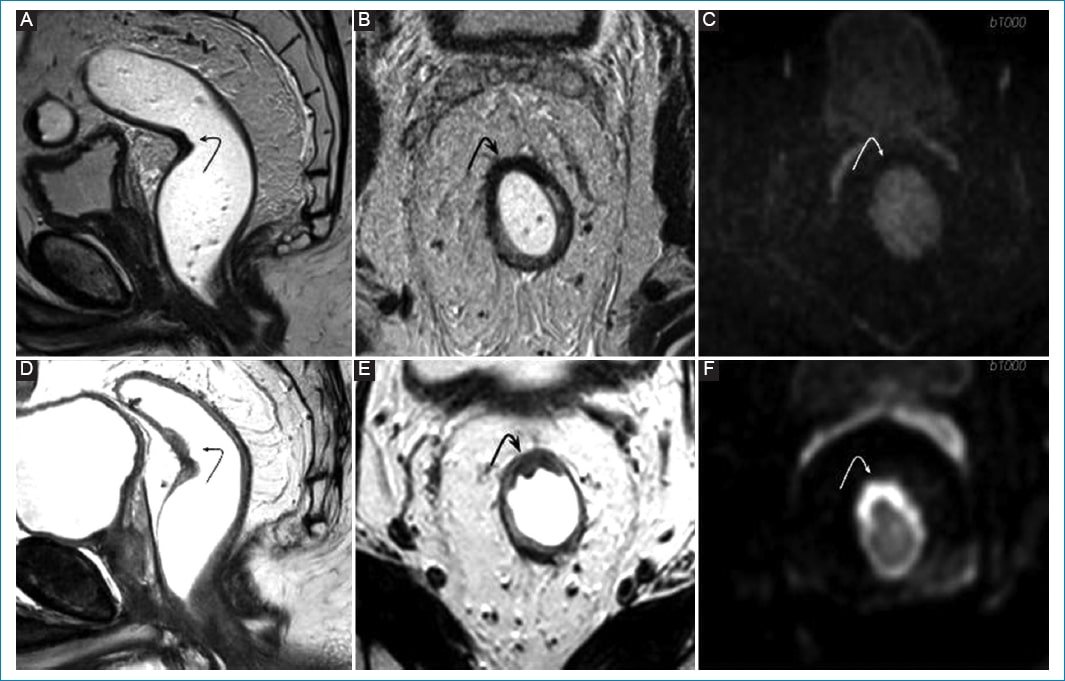
Figura 3. Recrecimiento tumoral intramural. Varón de 59 años bajo esquema WW por tumor de recto medio. Asintomático, estudios de control. A-C: RM de control 10 semanas posterior a neoadyuvancia. Se observa un área intraparietal de baja señal en relación con fibrosis posactínica (flechas en A y B). No se observan signos de restricción en DWI (flecha en C). TRG 1. D-F: RM de control a los 6 meses. Aparición de tejido de señal intermedia con crecimiento endoluminal (flechas en D y E) con restricción en DWI (flecha en F) compatible con recrecimiento tumoral.
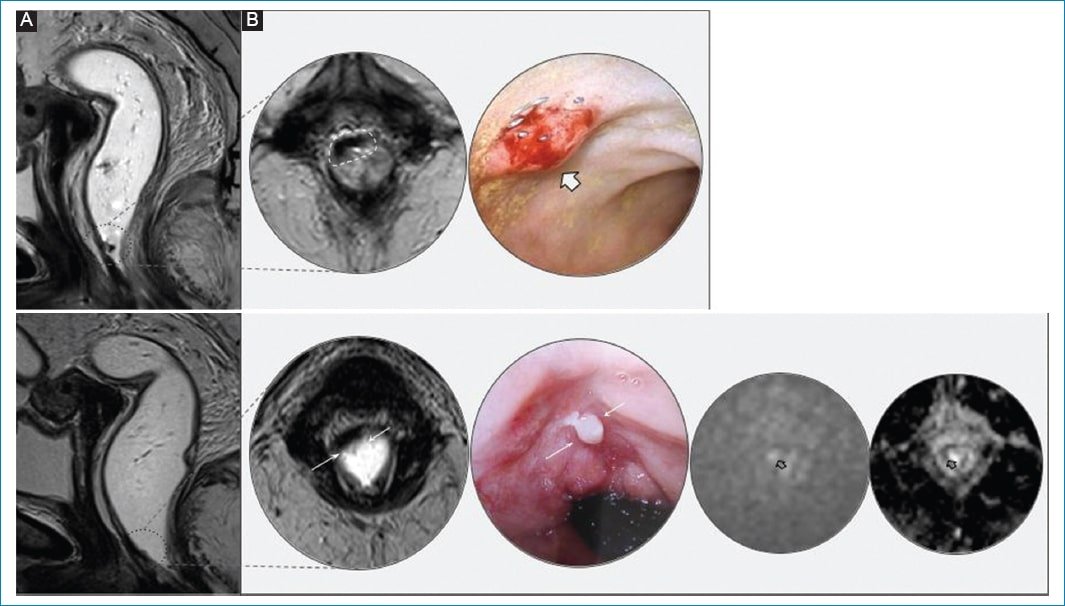
Figura 4. Recrecimiento tumoral intramural. Mujer de 66 años bajo esquema de WW. A: primer control tras neoadyuvancia (15 semanas). Área hipointensa de aspecto fibroso en hora 11-12, a 4 cm del margen anal (círculo discontinuo). La imagen ampliada muestra correlación con la endoscopía: telangiectasia en lecho tumoral, hallazgo consistente con respuesta completa. B: RM de control a los 6 meses. En el lecho fibroso se observa una imagen sobreelevada de señal intermedia de aproximadamente 4,5 mm atribuible a un pequeño recrecimiento adenomatoso, y su correlación endoscópica (flechas en las imágenes ampliadas). También son evidentes signos de restricción (flechas vacías).
La segunda forma corresponde a una sutil área de hiperintensidad en valores altos de b de la difusión. Es importante hacer esta distinción, ya que muchos de estos hallazgos en difusión pueden no tener un correlato en las secuencias potenciadas en T2 de alta resolución, pudiendo pasar desapercibidos tanto para el radiólogo como para el coloproctólogo en la evaluación10.
Por último, un engrosamiento parietal no conocido dentro del área cicatrizal debe considerarse un hallazgo indirecto de recrecimiento tumoral11, por lo que su control debe ser estricto (Fig. 5).
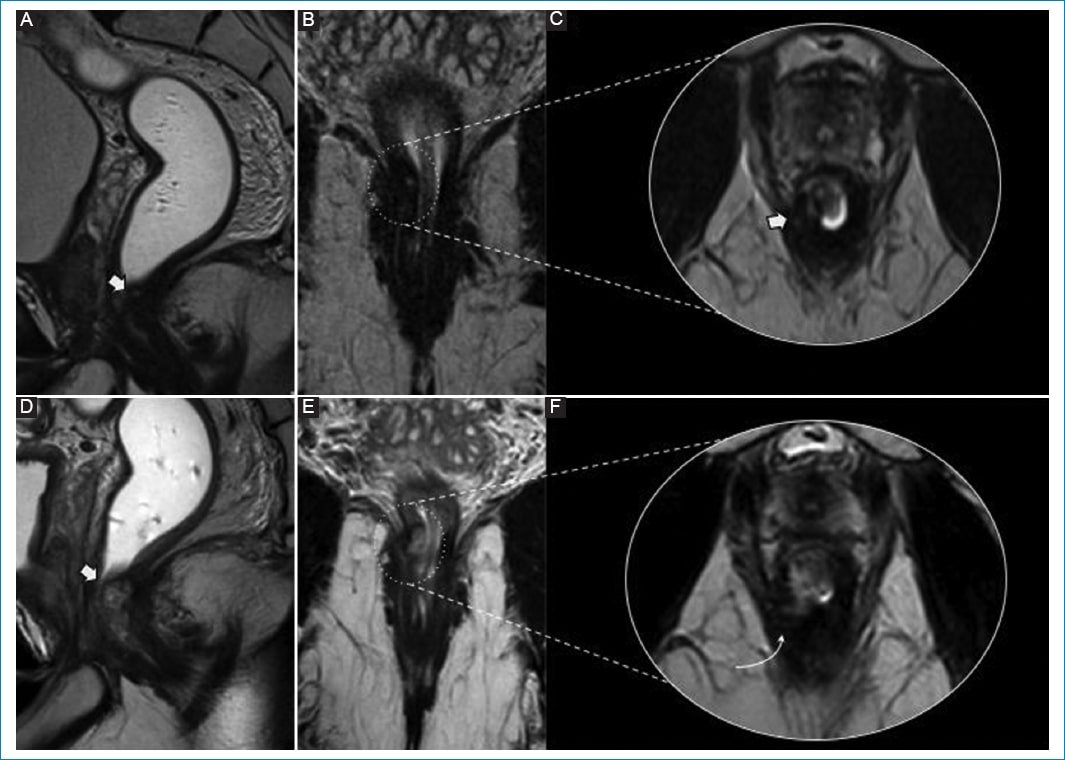
Figura 5. Recrecimiento tumoral intramural. Varón de 41 años bajo esquema de WW por tumor de recto inferior. A-C: flecha en RM de control 12 meses posterior a inicio de WW. Se observa un área de engrosamiento parietal de señal intermedia en la unión anorrectal (círculo punteado en B). D-E: RM de control 15 meses posterior al inicio de WW. Es más notoria el área de señal intermedia previamente descrita (flecha en D). Existe un claro componente endoluminal y borramiento de la capa muscular, mejor visible en la imagen ampliada (F) (flecha). La rectoscopía con toma de biopsia confirma la infiltración de la muscular propia por un adenocarcinoma moderadamente diferenciado.
Recrecimiento extramural
En este segundo grupo se incluye el recrecimiento tumoral que se desarrolla a partir de depósitos tumorales, ganglios mesorrectales o regionales extramesorrectales. Cabe mencionar que la cicatriz en el área donde se asentaba el tumor puede o no permanecer invariable por todos los métodos, siendo este tipo de recrecimiento invisible para los demás métodos de vigilancia.
Su correcto diagnóstico puede representar un desafío para el radiólogo, y su análisis debe basarse fuertemente en la comparación con exámenes previos.
Debe considerarse sospechoso de recrecimiento extramural todo aquel depósito tumoral o ganglio linfático que ha aumentado de tamaño, que ha perdido su forma oval habitual tornándose más redondeado o que se ha vuelto más irregular (Fig. 6).
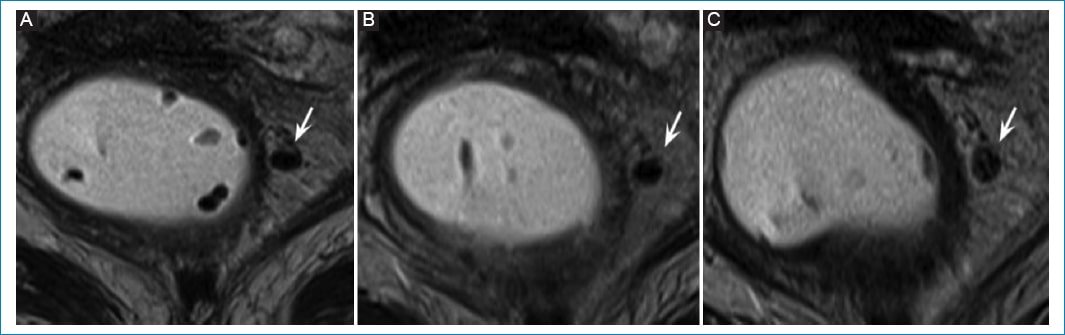
Figura 6. Recrecimiento tumoral extramural. Mujer de 80 años en seguimiento por cáncer de recto inferior. T3b N1 por ganglio mesorrectal en hora 3. Respuesta completa al tratamiento posterior a neoadyuvancia. A: RM posterior a neoadyuvancia. Depósito tumoral con signos de buena respuesta radiológica. B: RM de control 3 meses posterior al inicio de WW. Depósito tumoral discretamente aumentado de tamaño con respecto al examen previo, aunque con señal homogénea hipointensa. C: RM de control 6 meses posterior al inicio de WW. Depósito tumoral con cambios en su estructura, de aspecto heterogéneo y apariencia oval. La paciente evoluciona con progresión hepática, pulmonar y en el sistema nervioso central de su enfermedad de base.
La aparición de una señal intermedia o heterogénea intraganglionar, similar a la descrita para los recrecimientos murales, es también una característica de alta sospecha (Fig. 7). Las secuencias DWI/ADC, si bien no son sensibles para determinar la respuesta ganglionar posterior a la neoadyuvancia5, durante el esquema WW un foco de alta señal en valores altos de b no conocido en estudios previos es sugestivo de recrecimiento10,11 (Fig. 8).
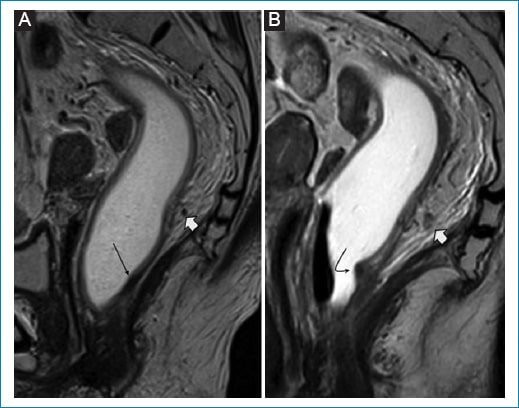
Figura 7. Recrecimiento tumoral extramural. Mujer de 73 años bajo esquema de WW por tumor de recto inferior. A: RM de control tras neoadyuvancia. Se observa tejido cicatrizal en relación con la pared del recto inferior (flecha fina). Depósito tumoral (N1) previo en hora 6 que muestra marcada disminución de tamaño (flecha gruesa). B: RM de control 6 meses posterior al inicio de WW. Depósito tumoral con mayor heterogeneidad y aumento en su tamaño (flecha gruesa). Engrosamiento parietal concomitante vinculable a recrecimiento mural sincrónico. (flecha delgada curva).
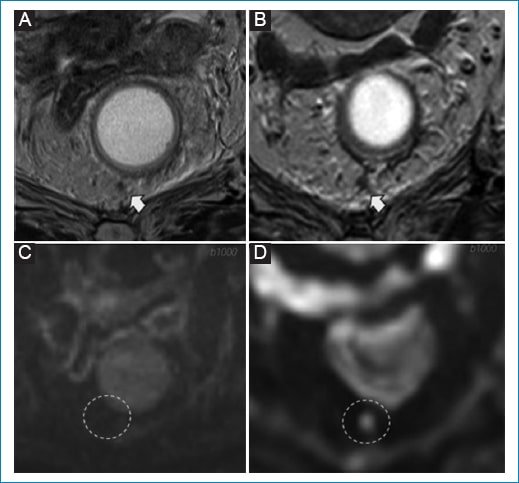
Figura 8. Recrecimiento tumoral extramural. Mujer de 73 años bajo esquema de WW por tumor de recto inferior. A y B: RM de control tras neoadyuvancia. Depósito tumoral previo en hora 6 reducido de tamaño y señal como signos de buena respuesta (flecha en A) y sin evidencia de restricción (círculo discontinuo en B). C y D: RM de control 6 meses posterior al inicio de WW. Depósito tumoral con mayor heterogeneidad y aumento de tamaño (flecha en C). El aumento de la señal en difusión (círculo discontinuo en D) y los signos de restricción en ADC (no mostrado) apoyan el diagnóstico de recrecimiento tumoral extramural.
Conclusión
La RM es un método determinante no invasivo para el diagnóstico y el seguimiento de los pacientes con cáncer de recto.
El recrecimiento tumoral es un término que aplica a la reaparición tumoral en pacientes bajo esquema de WW, sea parietal o bien por fuera de la pared.
La RM es el único método de vigilancia que permite una visión global en el seguimiento de los pacientes bajo esquema de WW, por lo que el radiólogo debe estar familiarizado con los diferentes patrones de recrecimiento tumoral en este campo en aumento que nos exige cada vez mejores protocolos de estudio, calidad de imágenes y calidad de los informes.
Financiamiento
Los autores declaran no haber recibido financiamiento para este artículo.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.