Estimados Editores:
La enfermedad de Pompe (EP), conocida también como glucogenosis tipo II o déficit de maltasa ácida, es producida por el déficit de la enzima α-glucosidasa ácida (GAA). Esta enzima, de localización lisosomal, es la encargada de metabolizar al glucógeno, y es codificada por el gen GAA1–6.
Los pacientes con EP pueden presentar síntomas precozmente, en forma tardía o permanecer asintomáticos durante toda su vida3–4.
Al producirse la falla metabólica, el glucógeno se almacena en exceso en los lisosomas, alterándose el mecanismo de autofagia, depositándose en los tejidos corporales, principalmente en el músculo esquelético y cardiaco, ocasionando miopatía metabólica vacuolar3–4.
Presentamos el caso de una paciente de 76 años que inicia con debilidad en cuatro miembros a predominio de los inferiores, de distribución proximal; compromete también músculos de la prensa abdominal y paravertebrales, con hiporreflexia de más de cinco años de evolución. Se agrega atrofia de estos grupos musculares y compromiso respiratorio. Actualmente se moviliza en silla de ruedas. Tiene diagnóstico de EP de inicio tardío.
Se realizan estudios complementarios: molecular, test genético y dosaje de enzimas por gotas de sangre en papel filtro, que evidenciaron una relación neutra/ácida lisosomal de 68,4 (valor referencial: < 30) y porcentaje de inhibición de GAA de 95,4 (VR: < 88) confirmando el diagnóstico de EPIT. Se encuentra en tratamiento de reemplazo enzimático (TRE) con estabilización de la progresión de los síntomas.
Basados en la aparición de síntomas, la EP puede clasificarse en una forma pediátrica o infantil (temprana) y otra juvenil o adulta (tardía). La variante infantil de la enfermedad fue descripta por primera vez por Pompe en 1932, mientras que Géry Hers identificó en 1963 la deficiencia de la GAA en los lisosomas. Es de causa autosómica recesiva, producida por una mutación en el brazo largo del cromosoma 17 (17q25.3)1,2,4–6.
La variante infantil, de presentación más severa y rápidamente progresiva, se produce en las primeras semanas de vida, con pronóstico ominoso, ocurriendo el deceso al primer año de vida; ocasiona: miopatía, hepatomegalia, debilidad muscular, cardiomiopatía y falla respiratoria1–4,6. La segunda variante se desarrolla después del primer año (lentamente progresiva), puede hacerse sintomática en cualquier etapa de la vida adulta, comprometiendo a los músculos esqueléticos y respiratorios1,3,4.
Tiene una incidencia global de 1:40.000, con variaciones regionales geográficas, por ejemplo, África o sudeste asiático, donde puede llegar a 1:14.0001,4,6.
La forma de presentación infantil se hace sintomática cuando la actividad enzimática (GAA) es menor al 10%, mientras que en la forma tardía ocurre cuando es menor al 40%1,4,6.
Los síntomas y signos más comunes de la EP (en las dos formas de presentación) son: fatiga, debilidad muscular lentamente progresiva de predominio proximal, que declina con más rapidez en miembros inferiores que superiores. El trastorno en la marcha es la consulta principal en la forma adulta. Debilidad en la lengua, disartria, mialgias, hiporreflexia/hipotonía, contracturas, deformidades (escoliosis), cuadriparesia, retraso en el desarrollo motor. Ptosis palpebral unilateral o bilateral, sin compromiso de músculos extraoculares, miocardiopatía hipertrófica, disnea, ortopnea, apnea del sueño, infecciones respiratorias a repetición, macroglosia, disfagia especialmente en estadios avanzados, etc.1,4,6.
Los grupos musculares más frecuentemente afectados son: cintura escapular (subescapularis), paraespinales (multifidus y longuissimus), pared abdominal (rectus abdominalis, obliquus internus y trasversus abdominalis), cintura pelviana (psoas-illiacus y gluteus maximus y medium), muslo (aducctoris, vastus lateralis y vastus medialis) y lengua (genioglossus)4,7.
El diagnóstico de la EP se realiza mediante valoración clínica, estudios moleculares (ADN), biopsia muscular, análisis de actividad enzimática, resonancia magnética (RM), enzimas musculares, electromiograma y radiografía de tórax1,6,7.
En esta patología la RM se emplea para: diagnóstico (patrón de afectación muscular característico), seguimiento de progresión de enfermedad (utilizando diferentes escalas, Mercuri o Kornblun) o como guía de biopsia4.
Los músculos, debido al almacenamiento excesivo de glucógeno, se vuelven hipoatróficos, apreciándose en RM con diversos grados de hiperintensidad en T1 y T2 e hipointensos en secuencias ponderadas para supresión grasa (STIR)4,5,7.
La secuencia ponderada en T1 permite estudiar el grado de infiltración grasa en los músculos, mientras que las secuencias T2 y STIR valoran la presencia de edema muscular8 (Fig. 1).
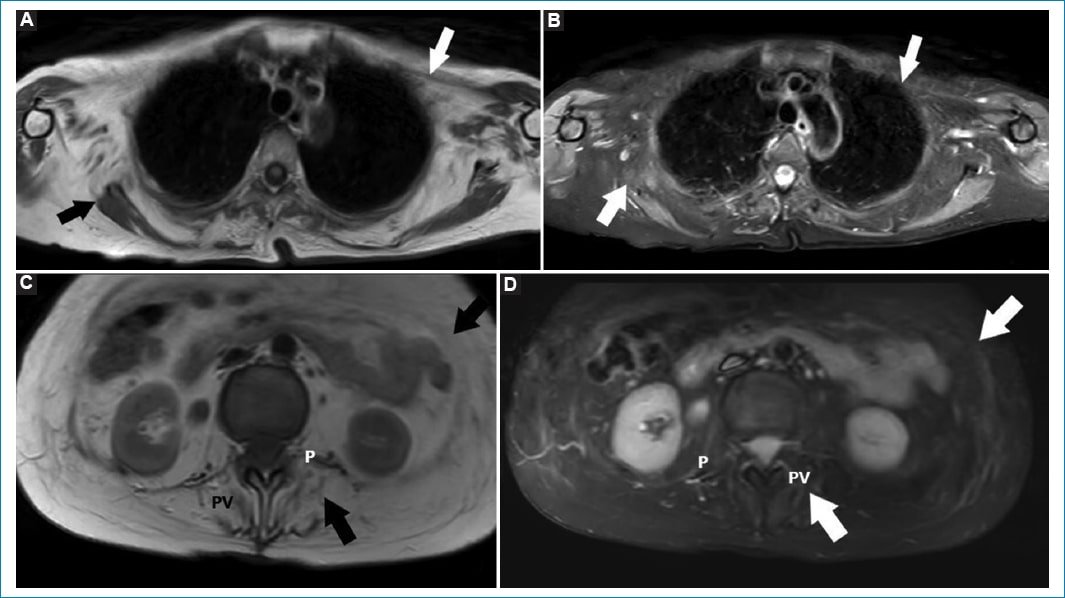
Figura 1. (A-D) Imágenes corporales para valorar morfología y señal de paredes musculares toraco-abdominales. Planos: axial T1 (A) y STIR (B) de tórax; axial T1 (C) y STIR (D) de abdomen. Se evidencia marcada hipoatrofia muscular por infiltración adiposa, apreciándose hiperintensidad en T1 e hipointensidad en STIR (flechas). El compromiso de los músculos paravertebrales (PV) y del psoas (P) son característicos de EP.
La afectación de los músculos de la lengua genera depósito de lípidos junto a hipoatrofia, mostrando hiperintensidad característica en secuencias ponderadas en T1. Esta particularidad se denomina signo de “la lengua brillante” (bright tongue)9,10. El diagnóstico diferencial debe realizarse con otras enfermedades neuromusculares, como esclerosis lateral amiotrófica, distrofias miotónicas tipo I, miositis con cuerpos de inclusión, etc.9,10 (Fig. 2).
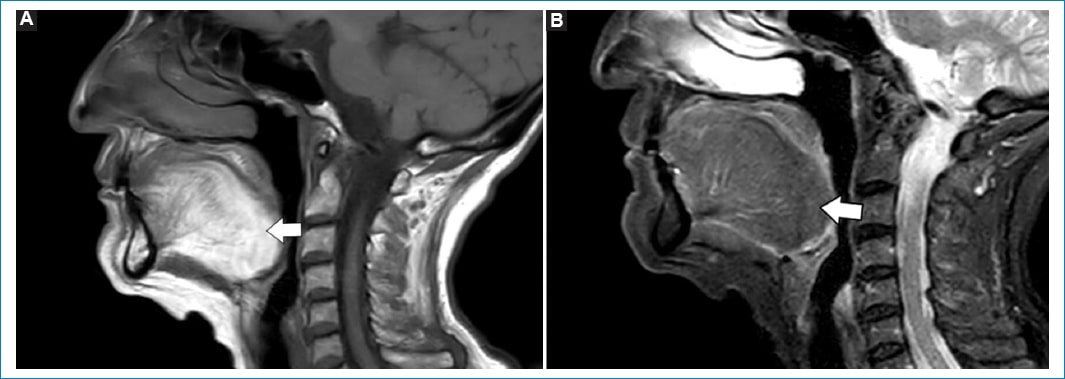
Figura 2. Plano sagital de RM de la cavidad oral ponderados en secuencias ponderadas en T1 (A) y STIR (B). La lengua se aprecia hiperintensa en T1 (flecha), originando el “signo de la lengua brillante”, como consecuencia de la infiltración grasa. En STIR esta se observa hipointensa (flecha).
La EP se trata con terapia de reemplazo enzimático (α-glucosidasa ácida recombinante humana)1,6.
Agradecimientos
Los autores agradecen a Lorena Cuellar, Licenciada en Producción de Bioimágenes, quien, con su pericia y capacidad, permitió obtener las figuras de este artículo.
Financiamiento
Los autores declaran no haber recibido financiamiento para este estudio.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Uso de inteligencia artificial para generar textos. Los autores declaran que no han utilizado ningún tipo de inteligencia artificial generativa en la redacción de este manuscrito ni para la creación de figuras, gráficos, tablas o sus correspondientes pies o leyendas.