Introducción
La neurorradiología desempeña un papel importante en el diagnóstico de los tumores del sistema nervioso central (SNC), tanto para definir el tratamiento como para el seguimiento a corto y largo plazo. La resonancia magnética (RM) es un estudio que permite la detección de los tumores del SNC. Las técnicas de imagen avanzadas, como la difusión (DWI), el coeficiente de difusión aparente (ADC), la espectroscopía y la perfusión, ofrecen un conocimiento sobre la microestructura tumoral, los cambios fisiopatológicos, la función y las propiedades del tejido, generando una aproximación al diagnóstico molecular1–3. La Organización Mundial de la Salud (OMS) introdujo desde el año 2016 la biología molecular como determinante para la clasificación de los tumores del SNC y como herramienta para establecer el pronóstico y la respuesta terapéutica4.
Los gliomas son los tumores más frecuentes del SNC en pediatría, constituyendo el 47% de estos. Se pueden clasificar dependiendo de la célula glial de origen y varían desde gliomas de bajo grado hasta gliomas de alto grado5,6.
Los gliomas de bajo grado son un grupo heterogéneo de lesiones que se caracterizan por ser tumores localizados, poco infiltrativos, de crecimiento lento, con un excelente pronóstico y sobrevida a largo plazo con los tratamientos actualmente disponibles2,6.
Los gliomas de alto grado, por otro lado, son lesiones difusas, altamente infiltrativas, que conllevan un mal pronóstico, con una sobrevida del 10-30% a los dos años2,6.
La ocurrencia de un segundo tumor en pediatría, definido como una nueva neoplasia histológicamente diferente del primer tumor, que ocurre luego de la exposición a radioterapia y no asociado a facomatosis, es una complicación infrecuente, pero que hay que tener presente en la población pediátrica, por la mayor sobrevida que se ha logrado con el avance del tratamiento oncológico y la alta exposición a radiaciones ionizantes. Este es un evento multifactorial que depende de la edad, la predisposición genética y el tratamiento recibido, entre otras variables. La radioterapia craneal es un factor de riesgo significativo conocido para el desarrollo de una segunda neoplasia7.
Caso clínico
Presentamos el caso de un paciente de 9 años con diagnóstico de meduloblastoma de fosa posterior con metástasis intracraneales al diagnóstico (tercer ventrículo), el cual fue tratado con exéresis quirúrgica subtotal (2017), radioterapia cráneo-espinal (con boost en la fosa posterior) y quimioterapia (finalización en 2018) (Fig. 1).
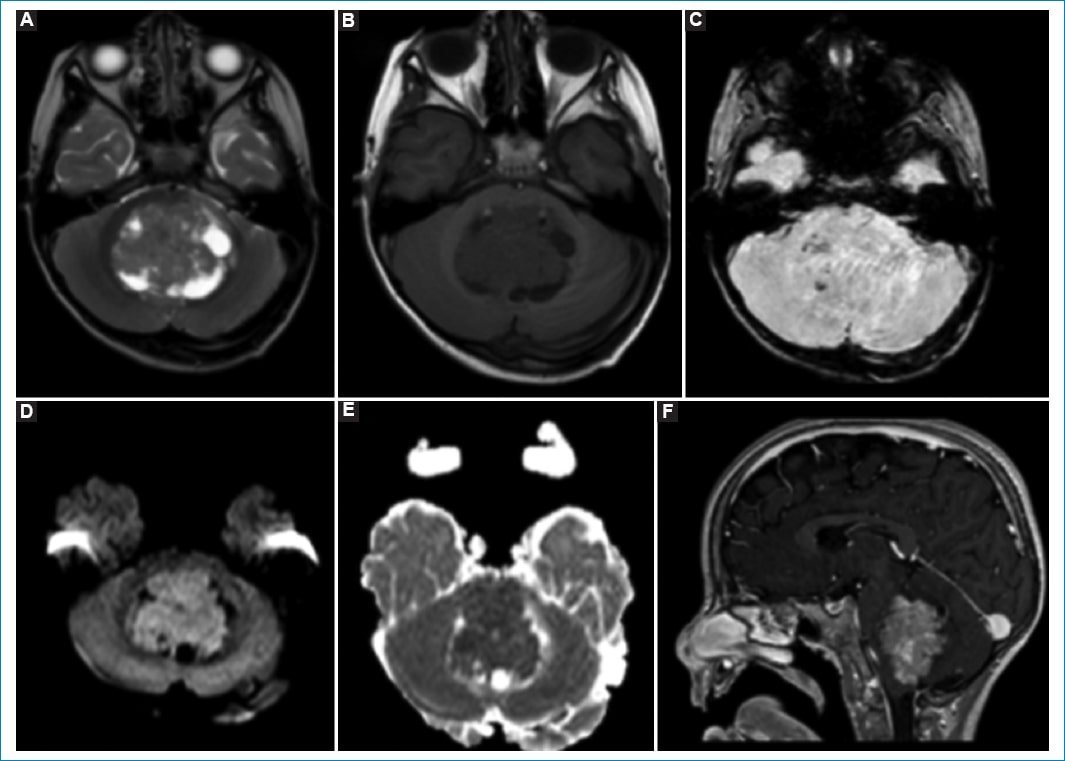
Figura 1. Formación expansiva predominantemente sólida con áreas quísticas/necróticas en IV ventrículo dilatado, con efecto de masa sobre el parénquima cerebeloso periventricular, desplazamiento y compresión ventral del tronco encefálico, colapsando las cisternas peritroncales. Presenta señal iso-hipointensa ponderada en T1 (A) y T2 (B), con restricción en secuencia DWI (D y E) e imágenes puntiformes hipointensas en SWI (C), pudiendo corresponder a calcificaciones. Secuencia ponderada en T1 poscontraste (F) con refuerzo heterogéneo.
Por presentar hidrocefalia requirió la colocación de derivación ventriculoperitoneal (DVP), la cual presentó complicaciones infecciosas, colocándose en última instancia una DVP regulable externa.
Continuó con controles clínicos e imagenológicos según protocolo, en los que no se observaron signos de lesiones inducidas por radioterapia en el parénquima encefálico en los siguientes controles anuales.
En la RM de control, cuatro años después de la finalización del tratamiento (2022), se observa una lesión focal en la sustancia blanca lobular temporal posterior derecha cuyo centro muestra señal isointensa con el líquido cefalorraquídeo (LCR) sin restricción en DWI, cuya pared es sutilmente hipointensa ponderada en T2 e hiperintensa en T1. Presenta refuerzo anular tras la administración de contraste intravenoso, con discreta nodularidad en su margen interno, y edema vasogénico perilesional con leve colapso del cuerno posterior del ventrículo lateral homolateral. Mide aproximadamente 16 × 12 mm. Se sospecha una lesión de probable origen infeccioso (Fig. 2).
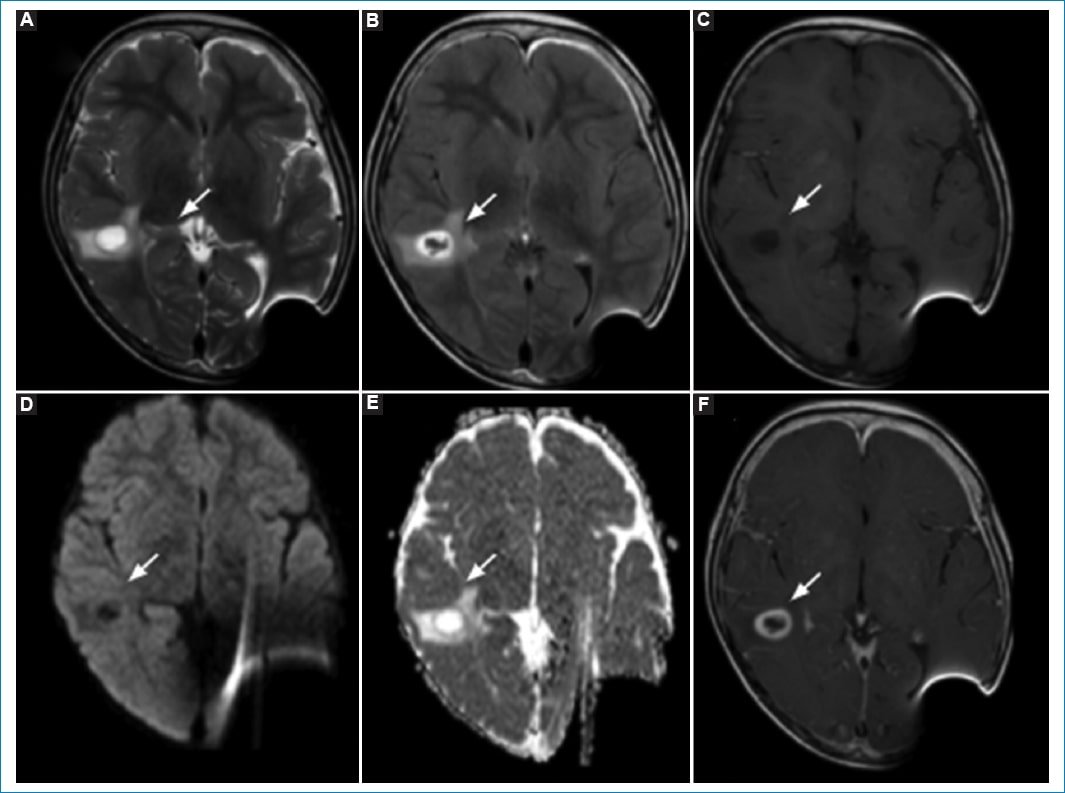
Figura 2. RM de control seis años después de la exéresis de la lesión primaria, donde se observa una lesión focal en la sustancia blanca temporal posterior derecha, cuya pared es sutilmente hipointensa ponderada en T2 (A) e hiperintensa en T1 (B), y (C) el centro muestra señal isointensa con el LCR sin restricción a la difusión (D y E). Presenta refuerzo anular tras la administración de contraste intravenoso (F), con discreta nodularidad en su margen interno.
Se realizó biopsia de la lesión, obteniendo un diagnóstico histopatológico de glioma difuso de alto grado de tipo pediátrico IDH de tipo salvaje, H3 de tipo salvaje, amplificación C-MYC y N-MYC negativa, grado IV de la WHO (2021) (Fig. 3).
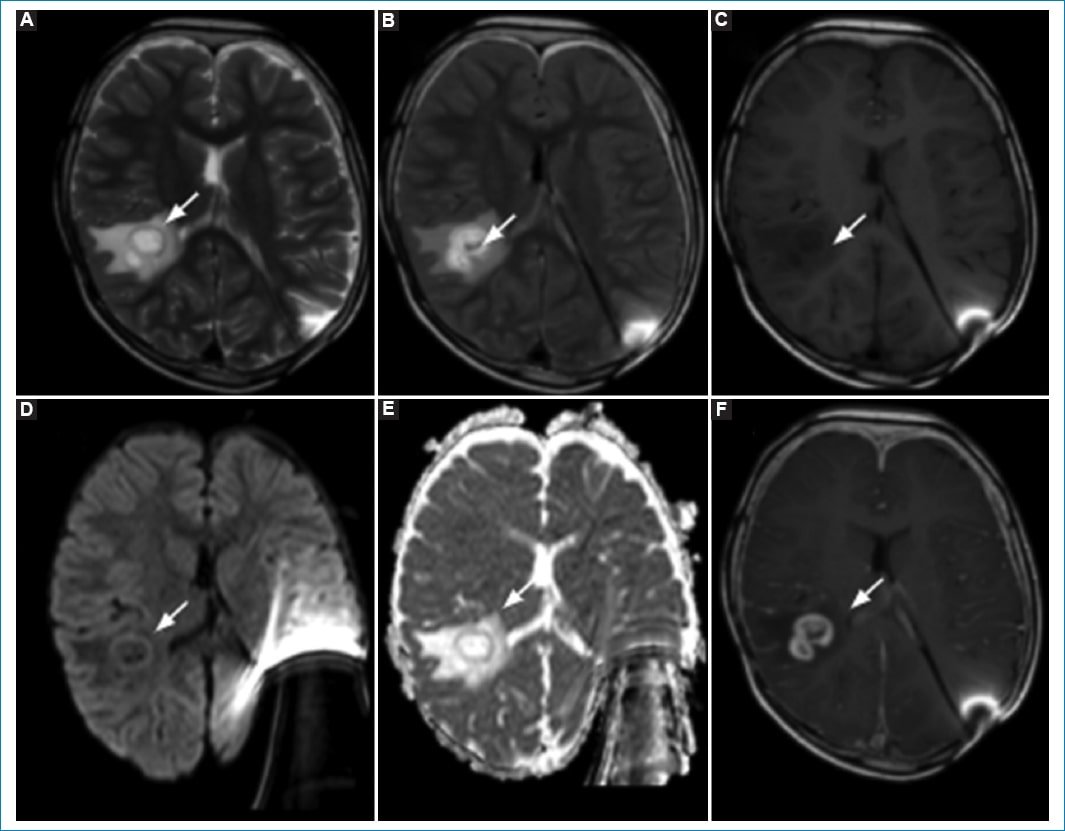
Figura 3. RM de control a los tres meses del último control, donde observa progresión con mayor confluencia de las anomalías de señal en T2(A)-FLAIR (A y B) del parénquima temporal posterior derecho, actualmente con imagen quística de márgenes engrosados irregulares hiperintensos en T1 (C) con leve restricción de la difusión de la pared (D y E) y realce en anillo poscontraste intravenoso (F).
Discusión
Presentamos el caso clínico de un paciente pediátrico con diagnóstico de meduloblastoma de fosa posterior y un tumor radioinducido supratentorial (glioma de alto grado), diagnosticado cuatro años después de la radioterapia, que presentó un desafío en el diagnóstico neurorradiológico por sus características inusuales.
Es un reto de la neurorradiología actual poder establecer, previo al tratamiento quirúrgico, la etiología de las lesiones del SNC en pacientes oncológicos, quienes por su patología de base pueden presentar recurrencias de la enfermedad, infecciones oportunistas, segundos tumores y cambios posradioterapia, entre otros.
Es sabido que los gliomas radioinducidos se originan en pacientes que han recibido tratamiento radiante para tumores primarios, más frecuentemente en aquellos con leucemia linfoblástica y meduloblastoma, luego de un período de latencia entre 2,5 y 35 años. Estos gliomas suelen ser más agresivos, con ampliación de PDGFRA y pérdida de CDKN2A/B, H3/IDH negativos8, al igual que el segundo tumor diagnosticado en nuestro paciente9.
Las características radiológicas del glioma difuso de tipo pediátrico H3/IDH de tipo salvaje son lesiones con efecto de masa y refuerzo poscontraste heterogéneo y anular; sin embargo, los tumores con amplificación del gen pueden ser más circunscritos, con leve edema perilesional y realce homogéneo tras la administración de contraste10,11.
Cabe destacar que algunas series aseveran que los gliomas difusos de la línea media son un caso atípico dentro de los tumores de alto grado, con respecto al comportamiento en ADC, siendo similares a los tumores de bajo grado12. Estos mismos plantean que la DWI junto con el ADC tienen mayor utilidad en la diferenciación de tumores infrantentoriales que en los supratentoriales2.
Por otro lado, como diagnóstico diferencial de lesiones que poseen un realce en anillo con el contraste en pacientes oncológicos, como nuestro caso, deben plantearse la necrosis posradiación, los abscesos cerebrales y las lesiones granulomatosas. En todos ellos podemos encontrar imágenes que presentan un realce con contraste en anillo y edema vasogénico. Utilizando la secuencia DWI pueden diferenciarse las lesiones hipercelulares (tumores de alto grado y abscesos) que muestran restricción a la difusión. Sin embargo, existe un número pequeño de gliomas de alto grado que muestran un realce en anillo, con poca restricción en DWI, sobre todo en áreas necróticas intratumorales1,13.
Aun así, continúa siendo un reto diferenciar en las técnicas de imágenes los tumores de alto grado que muestran características similares a lesiones de bajo grado, por presentar, generalmente, hemorragias intratumorales, áreas de necrosis o licuefacción, sobreinfección piógena, etc.
En nuestro caso, el paciente presentaba una lesión de bordes netos, con realce en anillo, sin restricción a la difusión y gran edema perilesional, que llevó al diagnóstico diferencial de una lesión de tipo granulomatoso.
Creemos que es necesario continuar desarrollando y perfeccionando nuevas técnicas de RM para poder aportar un diagnóstico certero previo a una intervención quirúrgica, en especial en la población oncológica pediátrica.
Financiamiento
Los autores declaran no haber recibido financiamiento para este estudio.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los padres del paciente referido en el artículo. Este documento obra en poder del autor de correspondencia.
Uso de inteligencia artificial para generar textos. Los autores declaran que no han utilizado ningún tipo de inteligencia artificial generativa en la redacción de este manuscrito ni para la creación de figuras, gráficos, tablas o sus correspondientes pies o leyendas.